研究人员利用人诱导性多能干细胞抗击糖尿病
糖尿病正在逐渐成为现代最大的健康挑战之一。根据世界卫生组织(WHO)的统计,每10人中就有一人患有糖尿病,而且根据最新的公开数据,这种疾病病是2016年160万人死亡的直接原因。自那以后,世界卫生组织已将糖尿病与癌症、呼吸系统疾病和心血管疾病一起指定为全球卫生当局要处理的四大重点非传染性疾病。
新加坡卫生部指出,有40万新加坡人患有糖尿病。这构成了当地疾病负担的10%。与此同时,新加坡国立大学的一项独立研究预测,如果按照当前的趋势继续下去,到2050年,新加坡将拥有1百万名糖尿病患者。新加坡卫生部长颜金勇(Gan Kim Yong)对不加控制的慢性疾病的潜在后果保持警惕,宣布了一场“抗击糖尿病的战争”,呼吁全国共同努力,预防这种疾病的发生和更好地控制疾病症状。
阻止糖尿病浪潮(sugar tide)
尽管表现为简单疾病,但糖尿病实际上有多种形式。I型糖尿病的发生是由于自身免疫反应破坏了位于胰腺中产生胰岛素的细胞,即β细胞。另一方面,II型糖尿病(T2D)发生的原因是细胞不再对胰岛素产生反应。鲜为人知的是单基因糖尿病(monogenic diabetes)---一种罕见的糖尿病,是由单个基因的突变引起的。
新加坡科技研究局(A*STAR)分子与细胞生物学研究所首席研究员Adrian Teo说,“然而,随着时间的流逝,胰岛β细胞衰竭和β细胞死亡是所有类型糖尿病的共同特征。尽管目前的糖尿病药物可以帮助患者长时间控制血糖水平,但它们不能治愈甚至不能改善胰腺β细胞的健康。”他补充道,尽管在西方,肥胖是导致糖尿病的主要因素,但是在亚洲,导致糖尿病的主要因素是胰腺β细胞衰竭。
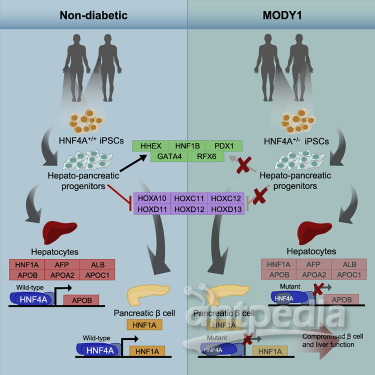
图片来自iScience, 2019, doi:10.1016/j.isci.2019.05.032。
这就是为什么Teo的研究团队认为有潜力利用干细胞的力量来抗击糖尿病。与体内大多数细胞不同,干细胞具有自我更新的能力,可以分化为多种细胞类型,包括胰腺β细胞。因此,干细胞有可能被用来替代糖尿病患者体内已死亡的胰腺β细胞,从而恢复这些患者的胰岛素产生和葡萄糖调节能力。
Teo设想不是从胚胎中获取干细胞,而是从糖尿病患者那里获得血细胞和成纤维细胞(皮肤中的一种细胞),然后将它们重编程为人诱导性多能干细胞(hiPSC)。随后,在将这些hipsC分化为胰腺β细胞并将它们移植回患者之前,可以进行基因编辑以校正与糖尿病相关的突变或基因变异。
Teo实验室博士生Blaise Su Jun Low说,“这种方法潜在地允许几乎无限量地供应胰岛β细胞用于细胞替代疗法。由于是将自身的细胞移植患者体内,移植排斥的可能性较小。”
另一种发现方式
除了细胞替代疗法外,hiPSC还可以帮助阐明糖尿病的潜在分子机制。比如,Teo的研究团队使用源自经诊断患有MODY(maturity-onset diabetes of the young, 青年发病的成年型糖尿病,它是单基因糖尿病的一种亚型)的患者的hipsC,以了解某些基因网络如何控制胰腺和肝脏发育。这两个器官对于正常的葡萄糖代谢至关重要。
大致的实验设置如下所示:首先,Teo团队诱导源自MODY患者的hiPSC(下称MODY hiPSC)分化为前肠内胚层和人类胰腺前体---人类胚胎中最终会产生胰腺和肝脏的部分,然后产生胰腺β细胞样细胞(beta-like cell)。他们将源自MODY hipsC的前肠内胚层、胰腺前体和β细胞样细胞的基因表达模式与正常人进行了比较。
通过这种方法,Teo团队发现了一种名为HNF4A的基因中的突变会导致MODY 1患者中指定胰腺和肝脏发育的基因的总体表达下降。重要的是,Teo指出,使用小鼠模型不可能取得这一发现,这是因为与人类中的情形不同,具有HNF4A突变拷贝的小鼠不会患上糖尿病。
Teo解释说,“目前,有超过14种形式的MODY,每种都是由一种不同基因(比如HNF4A、HNF1A、PAX4和INS)中发生的突变引起的。有趣的是,在许多这些MODY基因中发现的基因变异与II型糖尿病有关,而II型糖尿病是糖尿病的最常见形式,影响了大约90%的糖尿病患者。”Teo补充道,来自MODY患者的发现可能与T2D的病理生理学有关。
此外,通过将hipsC用作基因筛选的平台,科学家们就有可能能够更好地将患者分为不同的治疗组。与此同时,有可能基于这样的筛选方法鉴定出新的药物靶标。这将使得糖尿病精准医疗的理想更接近现实---一刀切的解决方案并不适用于所有患者,应当根据每名糖尿病患者特有的内在遗传缺陷来开处方。
继续开展研究
HiPSC在糖尿病的基因筛查和药物发现中的使用已经在世界各地的许多实验室中进行。另一方面,涉及利用hipsC替代功能异常的胰腺β细胞的疗法在批准用于临床之前还有一段路要走。
Low提醒说,将hipsC分化为胰腺β细胞的方案还没有100%有效,而且一些残留的多能性细胞可能仍在分化的胰腺β细胞中潜藏着。她说,如果这些多能性细胞也与胰腺β细胞一起移植,那么它们可能会导致畸胎瘤---一种可能导致危及生命的并发症的肿瘤。
Teo继续说,由hipsC产生的胰腺β细胞的确切功能尚未得到充分验证。他提醒说,“它们需要像真正的人类胰腺β细胞或胰岛一样发挥作用。否则,个人的葡萄糖水平将无法得到适当调节,从而带来健康风险。”
另一个需要关注的是基因编辑技术(比如流行的CRISPR/Cas9系统)在校正与糖尿病相关的基因突变时的安全性。Teo说,除非可以排除CRISPR介导的基因组编辑的不良或意想不到的脱靶后果,否则使用经过基因编辑的hipsC进行细胞替代治疗的可能性可能仍然有限。
尽管面临这些挑战,Teo团队仍然保持乐观,没有被吓倒。他说,“对于没有经过任何基因组编辑的基于hiPSC的细胞疗法,目前正在进行一些临床试验,以评估这些hiPSC产生胰腺β细胞并调节血糖水平的能力。我们的实验室以及世界上许多其他实验室正在努力优化胰腺分化方案,以消除残留的hiPSC并改善hipsC产生的胰腺β细胞的功能,从而使得它们的行为与胰岛中真正的胰岛素分泌细胞相类似。”
在抗击糖尿病方面,Teo强调了实验室与诊所之间密切合作的重要性。他强调说,“我们相信与临床医生和胰腺移植外科医生的合作是一种双赢模式,可以帮助我们将科学努力最终转化为对患者和社会的治疗价值。”
-
科技前沿
-
焦点事件
-
项目成果
-
焦点事件

-
科技前沿

-
焦点事件