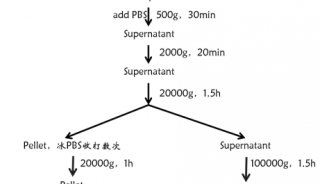
神经细胞与外泌体研究进展
胶质细胞与外泌体
胶质细胞占CNS细胞的90%,主要包括小胶质细胞、星形胶质细胞以及少突胶质细胞。小胶质细胞是存在于CNS的巨噬细胞,占CNS细胞总数的10%。在生理状态下,小胶质细胞主要起到免疫监视作用。脑缺血后,小胶质细胞分泌肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-1、IL-6等促炎性细胞因子,进而促进神经元死亡并调控小胶质细胞的吞噬功能。星形胶质细胞是CNS中数量最多的细胞,在脑缺血后同样可通过释放促炎性细胞因子损伤神经元。少突胶质细胞是CNS中产生髓鞘的细胞,对于维持轴突完整性至关重要。
研究表明,小胶质细胞可分泌含有氨肽酶和乳糖转运体单羧酸转运体的外泌体,这些会造成神经肽的降解。经ATP刺激后,小胶质细胞分泌的外泌体还能通过影响神经鞘脂代谢而增加突触前神经递质的释放,从而增加兴奋性神经传递。Gabrielli等的研究显示,小胶质细胞外泌体表面携带有内源性大麻素N-花生四烯乙醇胺,可以与突触前1型大麻素受体结合,从而减少抑制性神经递质γ-氨基丁酸的释放。此外,小胶质细胞外泌体中还含有IL-1β,后者可参与炎症反应。目前关于小胶质细胞外泌体参与缺血性卒中病理生理学改变的研究较少,还有待进一步研究。
星形胶质细胞外泌体中含有突触蛋白1,这是一种神经细胞黏附分子结合伴侣。OGD时,外泌体中的突触蛋白1能促进神经突起生长和神经元存活。与此同时,神经元外泌体内含有的miR-124a能被星形胶质细胞摄取,继而上调兴奋性氨基酸转运体2/谷氨酸盐转运体1表达,导致星形胶质细胞摄取谷氨酸盐的能力提高,从而影响突触活动。
少突胶质细胞分泌的外泌体能进入神经元并提升其活性。使用少突胶质细胞的外泌体进行处理后,OGD神经元死亡率显着降低。研究表明,少突胶质细胞外泌体能激活包括蛋白激酶B和细胞外信号调节蛋白激酶1/2在内的促存活因子,而且还能向神经元传递超氧化物歧化酶和过氧化氢酶等抗氧化物酶,从而对神经元起到保护作用。
外泌体与缺血性卒中的治疗
大量研究证实,间充质干细胞(mesenchymal stem cell, MSC)可通过促进脑损伤后的血管新生、神经再生以及脑白质重塑改善缺血性卒中。利用MSC的条件培养液处理OGD神经元显示,PI3K/Akt通路被激活,进而促进神经元存活。进一步将MSC条件培养液中的外泌体提取出来,通过静脉注入脑缺血模型小鼠体内,发现其可显着改善运动功能和促进神经血管再生。通过比较发现,MSC外泌体的疗效与单纯利用MSC的疗效相当,提示MSC来源的外泌体在MSC移植疗法中发挥着主要作用。
MSC外泌体中含有超过700种微RNA。将缺血脑组织提取物和MSC共培养后发现,MSC能分泌含有大量miR-133b的外泌体。与miR-133b低表达的MSC外泌体相比,miR-133b高表达的MSC外泌体能促进脑缺血模型大鼠的轴突再生和神经功能恢复。小G蛋白超家族成员RhoA是miR-133b的靶点,可抑制神经突起生长。将神经元与含有大量miR-133b的外泌体共培养后发现,RhoA表达下调,进而引起神经突起生长增多。
经过工程改造的造血干细胞分泌的外泌体能传递Sonic Hedgehog(Shh)信号蛋白,激活受体细胞Shh信号通路,从而促进梗死区周围的血管新生和神经功能恢复。而Shh对生理及病理状态下的神经再生至关重要,提示含有Shh的外泌体可能具有促进缺血性卒中后脑组织修复的作用。