免疫沉淀法浓缩蛋白质实验
免疫沉淀法
| 实验方法原理 |
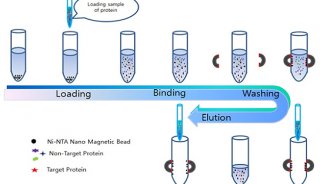
通过免疫沉淀,用蛋白质特异性抗体能够定量分离目的蛋白。免疫沉淀法由三个步骤组成。首先将特异性抗体加入细胞提取物,第二步加入经化学固定的金黄色葡萄球菌,以确保形成大量沉淀。这些细菌通过蛋白质 A 和抗体形成复合物,蛋白质 A 与免疫球蛋白的 Fe 部分有高度的亲和性。或者说,纯化的蛋白质 A 结合的 Sepharose 树脂,为从细胞提取物屮分离出抗原抗体复合物,提供了一个固体基质。最后通过洗脱,除去尚未沉淀的杂质。 为了除去已破碎的或固定差的细胞,在用于免疫沉淀(作用)之前可以预先洗涤金黄色葡萄球菌细胞。如果要使用蛋白质 A-Sepharose 树脂,应按厂家说明书预先膨润之。 |
|---|---|
| 实验材料 | 含蛋白质的样品 |
| 试剂、试剂盒 | 蛋白质特异性抗体 已固定的金黄色葡萄球菌或蛋白质 A-Sepharose 树脂 Tris NaCl EDTA NaN3 TritonX-100 缓冲液 A |
| 仪器、耗材 | Eppendorf 管 小型台式离心机 混旋器 |
| 实验步骤 |
1. 加过量的特异抗体于含有目的抗原的蛋白质溶液中。例如在 1 ml 沉淀混合物的溶液中应加入 10~25ug 的纯化抗体。 2. 混匀并在冰浴中孵育沉淀混合物 1 h 以上(杂交瘤上清液需 2~3 h)。 3. 加足够量的金黄色葡萄球菌或蛋白质 A-Sepharose 树脂以结合沉淀混合物中所有的免疫球蛋白分子,Calbiochem Standardized Pansorbin 细胞具有 2.0 mg/ml 的免疫球蛋白结合容量。Bio-Rad Affi-Gel 蛋白质 A 具有 6~7 mg/ml 的 IgG 结合容量。 4. 混匀并在冰浴中孵育 15~60 min。 5. 离心免疫沉淀物 15 s 或在 4℃ 3000×g 离心 10 min。 6. 用含有 0.05% TritonX-100 的缓冲液 A 冼涤免疫沉淀物 3~5 次,每次冼涤时,注意小心完全地使沉淀悬浮。 6.1 再将沉淀悬浮于 100 ul 洗涤缓冲液,混匀。 6.2 在 Eppendorf 离心管屮离心 15 s。 6.3 重复 6.1~6.2 步骤 2~3 次。 7. 将沉淀悬浮于 100 ul 样品缓冲液,或等电点聚焦缓冲液中,通常 1/8 的沉淀在凝胶电泳中就足以检测到蛋白质,当然这取决于蛋白质的起姶浓度,为了有效分离蛋白质混分物,须将样品加热到 100℃。
展开 |
| 注意事项 |
1. 为了除去凝聚物,在使用前成预先超速离心抗体溶液(160 000×g 离心 30 min 或 400 000×g 超速离心 10 min)。反复冻融将促进抗体的凝聚作用,因此应将抗体保存在水溶液中,为了灭活蛋白酶在使用前可将抗体在 56℃ 保温 30 min。 2. 用于免疫沉淀反应的金黄色葡萄球菌能够进行培养和制备,经福尔马林固定和热处理的金葡菌也可直接购入,制备的细胞收集于水溶液,-20℃ 贮存。 3. 将抗原提取物预先吸附于洗脱过的金葡菌的方法。能够减少非特异的金葡菌的结合。 4. 通过改变洗脱缓冲液的 pH 值、盐浓度、或去垢剂。可提高免疫沉淀反应的特异性, 5. 不同的免疫球蛋白对金葡菌结合时具有不同的亲和力,兔、人、豚鼠的免疫球蛋白具有很好的结合力。 6. 对小鼠和山羊抗体的最大结合力分别在 pH8 和 pH9 的条件下。将抗小鼠 IgG 抗体和金葡菌细胞预先温孵,可弥补小鼠 IgG1 和金葡菌细胞结合力差的缺点。 7. 蛋白质 G 是从链球菌中分离得到的,在结合抗体的性质方面类似于蛋白质 A。对不同种属抗体结合而言,蛋白质 G 比蛋白质 A 具有更好的结合性质。一种去除白蛋白结合域的蛋白质 G 衍生物偶联的 Sepharow 树腊已有产品面市(Pharmacia 产品)。 8. 免疫沉淀反应的样品缓冲液有时需要加尿素助溶。 9. 免疫沉淀反应之后释放抗原的条件是可利用 3.5 mol/L MgCl2,0.1 mol/L 枸橼酸钠(pH 3.0),3 mol/L 氨水或硫氰酸钾饱和的盐酸胍,0.2 mol/L 二碘水杨酸锂和 2-疏基乙醇洗涤免疫复合物。 10. 免疫沉淀物通常用放射自显影检出放射性标记蛋白,或者是通过免疫印迹来识别。但对照样品必须和金葡菌有交叉反应。 11. 建议电泳时要有适当的对照,以减少本底。
展开 |
-
仪器推荐

-
仪器推荐
 询底价 Tel:400-6699-117 转 5577
询底价 Tel:400-6699-117 转 5577 -
仪器推荐
-
仪器推荐

-
仪器推荐