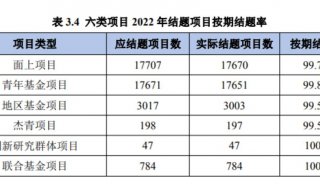
结直肠癌化疗抵抗新机制(二)
ABHD5通过提高自噬尿嘧啶产量来降低FU摄取
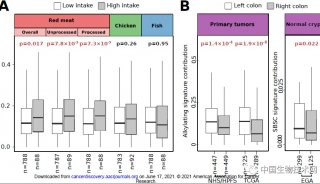
接下来,研究人员试图探索ABHD5调节pMMR结直肠癌细胞对FU反应的机制。首先他们比较了ABHD5敲除细胞和对照SW480细胞的胞内FU浓度。高效液相色谱分析结果十分醒目,与对照组细胞相比,ABHD5敲除细胞内的FU水平显著增加(图3)。
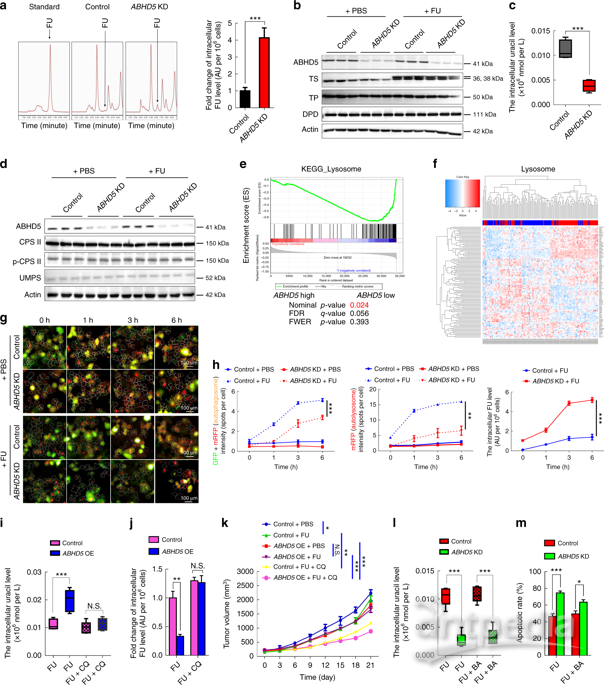
ABHD5基因细胞内的FU水平增加是由于药物吸收能力增加,然而代谢曲线显示,与对照组相比,这些细胞的尿嘧啶含量显著减少,表明ABHD5缺乏可能损害了尿嘧啶的产量,并促使pMMR结直肠癌细胞将FU作为尿嘧啶的外源性来源。在真核细胞中,两种酶(CPS
II和UMPS)负责嘧啶生物合成,而ABHD5敲除细胞和对照细胞的这些酶的表达水平均没有变化,表明在结直肠癌中ABHD5可能是通过一种全新的、独立途径影响尿嘧啶产量。
研究人员推测溶酶体RNA降解介导了自噬性尿嘧啶的产生,且归因于ABHD5诱导的pMMR/ABHD5high结直肠癌细胞尿嘧啶增加,从而促进了癌细胞对FU的抵抗。随后,研究人员的猜测得到了证实,一种通过靶向自噬体-溶酶体融合的自噬潮抑制剂“氯喹(Chloroquine)”有力地挽救了ABHD5过度表达SW480细胞中的尿嘧啶和FU浓度。这些细胞来源的异种移植物重新恢复了对FU的敏感性。由于课题组之前已经证明ABHD5通过激活BECN1来调节自噬,于是他们怀疑BECN1参与这种情况下的自噬尿嘧啶的产生。但是,结果恰恰出人意料,BECN1激活剂仅稍微逆转了ABHD5敲除SW480细胞的胞内尿嘧啶和对FU的反应,表明ABHD5调节自噬尿嘧啶的产生主要通过BECN1以外的机制调节。
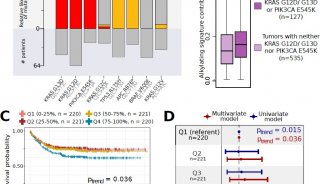
为了找到相关互作基因,研究人员通过超高液相色谱-多反应监测质谱(UHPLC-MRM-MS)分析在FU作用下,尿嘧啶相关核苷和核酸碱基随时间变化的含量。在FU处理期间,对照组胞苷和鸟苷含量显著增加,ABHD5敲除细胞仅有少量增加。已知溶酶体中的各种水解酶对大分子(如RNA)的降解是必不可少的,ABHD5可能对溶酶体中RNA降解的第一步所引起的RNA酶的活性起到关键的促进作用,进而导致自噬性尿嘧啶产量下降(图4)。
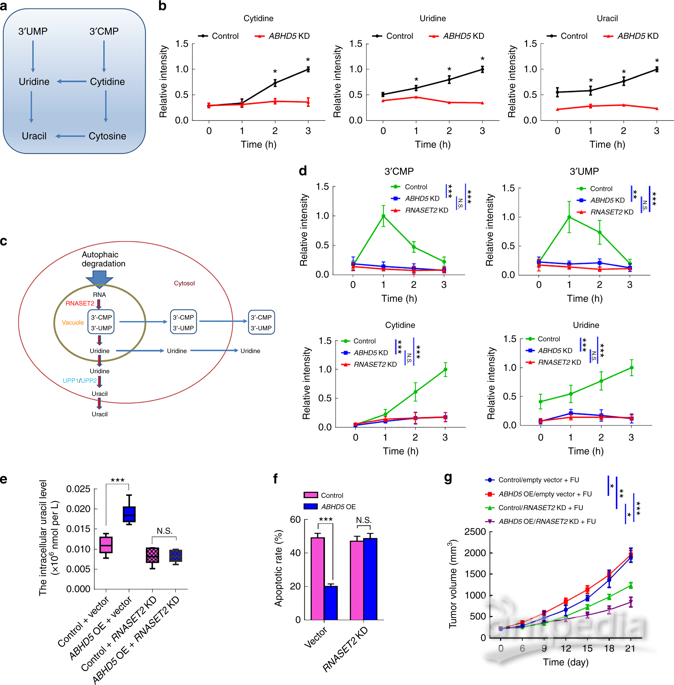
综合研究数据,ABHD5定位于溶酶体,与RNASET2共享PDIA4中的一个共同互作域。ABHD5直接与PDIA4相互作用,阻止PDIA4与RNASET2相互作用失活RNASET2。ABHD5一旦缺陷,PDIA4与RNASET2发生相互作用,使后者处于失活状态,损害RNASET2诱导的自噬尿嘧啶产量。
ABHD5缺乏可促进结直肠癌细胞将FU作为外源尿嘧啶摄入,从而增加其对FU的敏感性。相反,由于自噬尿嘧啶的产量增加,富含ABHD5的结直肠癌细胞对FU存在固有抵抗力。
本研究揭示了一种全新的结直肠癌化疗耐药性机制,为提高CRC化疗药物敏感性的潜在治疗策略提供了新思路。
原文检索:ABHD5 blunts the sensitivity of colorectal cancer to fluorouracil via promoting autophagic uracil yield
-
焦点事件
-
焦点事件

-
科技前沿

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿

-
焦点事件

-
科技前沿
-
企业风采

-
科技前沿
-
会议会展

-
焦点事件

-
科技前沿
-
焦点事件

-
科技前沿

-
科技前沿
-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
技术原理
-
焦点事件

-
技术原理

-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
项目成果

-
项目成果
-
焦点事件

-
项目成果
-
政策法规

-
项目成果

-
项目成果
-
焦点事件

-
焦点事件

-
科技前沿
-
企业风采

-
项目成果
-
项目成果
-
科技前沿
-
科技前沿
-
科技前沿
-
项目成果
-
企业风采