IVIg配方中的亚可见颗粒可活化人血清中的补体(四)
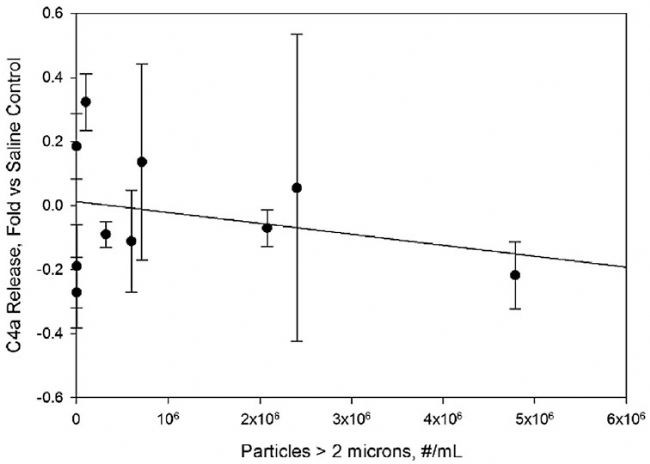
图6。IVIg样本中的蛋白颗粒没有刺激C4a浓度在人血清样本中的释放。据实验结果,在生理盐水对照样品中,fold与C4a水平相比浓度增加了。颗粒浓度是指IVIg制剂在稀释10倍于人血清之前的浓度。直线表示最小二乘线性拟合,相关系数为r2=0.005。
讨论
亚可见颗粒普遍存在于治疗性蛋白质的配方中,但在运输、处理和储存过程中遇到的应力变化会大大增加它们的水平。在运输和液体的日常处理过程中,由于振动引起的搅动压力。尽管治疗蛋白的液体配方通常在受控温度下保持液态,但意外冻结可能发生,特别是用凝胶包冷却的容器中,或在用于家庭管理的配方中,冷冻会在运输过程中发生。在这里测试的多克隆抗体配方中,当预先填充的注射器中的IVIg配方受到搅拌时,或当配方在小瓶中被冻融时,可以看到颗粒水平的增加。目前研究旨在调查蛋白配方中的亚可见颗粒是否提高补体激活的能力,所以我们使用了各种配方和加速压力条件下创建样本颗粒的大小和浓度,但我们没有试图阐明每个应力的详细机制促进粒子的形成。
冻融试验后观察到的颗粒浓度取决于药瓶类型和配方所受冻融循环次数。经过6次冻融循环,每mL样品可产生数百万个大于2mm的颗粒,数十万个大于10mm的颗粒。有趣的是,在玻璃瓶中经过多次冻融循环的样品比在聚合物SiOPlas™瓶中冷冻的样品产生了更多的颗粒。我们推测,与那些在更灵活的循环聚烯烃瓶中所经历的相比,玻璃瓶中更多的颗粒是由于冰在刚性玻璃瓶中膨胀时产生了更高的机械应力造成的。
注射器中IVIg配方的搅动所产生的颗粒数取决于所施加的搅动应力的强度、缓冲条件和注射器类型。在平板摇床上进行高强度通宵搅拌所产生的颗粒比低强度、端到端旋转10天所产生的颗粒要多。搅拌硅油润滑的预填充注射器会产生硅油液滴特征的球形颗粒,以及少量非球面的、近乎半透明的典型蛋白质聚集颗粒,这些颗粒看起来是由硅油液滴和聚集的蛋白质组成的。SiOPlas™注射器中产生的颗粒较少,其中等离子体化润滑层比液态硅油润滑层更不容易被流体剪切和界面张力从表面去除。
补体活化是一种不良反应,与许多纳米药物中的纳米颗粒存在有关。虽然许多类型的纳米颗粒已被证明可以激活补体,但也有其他纳米颗粒表现出最小程度的补体激活。纳米颗粒诱导的补体活化可通过经典途径、凝集素途径或其他途径发生。通过经典途径激活补体是抗原结合的IgG激活的一个特征。当与抗原结合的Igg的Fc区域组装形成六聚体复合物时,就会发生这种激活。相比之下,在本例中,Bb水平的增加对IVIg配方中的颗粒的响应表明补体是通过另一种途径激活的,可能是通过非特异性结合,不同于Fc介导的天然IgG功能的激活特征。蛋白质颗粒通过替代途径诱导补体活化的结构基础尚不完全清楚,但对于其他纳米颗粒,替代途径活化是补体级联蛋白C3非共价沉积在颗粒表面所致。
在IVIg配方中,补体对操作诱导颗粒的激活是很强的。即使在我们测试的产生最多微粒的冻融条件下,大多数蛋白质仍以单体形式可溶。例如,在玻璃瓶中经过6次冻融循环后,根据HPLC分析的单体损失,只有3.7%的原1
mg/mL的单体蛋白聚集在37微克/mL的颗粒上。然而,这少量的集合体引发了Bb、C3a和C5a的释放,其释放水平大约是1
mg/mL阳性对照酵母聚糖和热聚集伽马球蛋白释放水平的四分之一。
应用于玻璃和SiOPlas™容器中的IVIg配方的冻融和搅拌应力产生了跨越几个数量级的颗粒数,通过流式颗粒成像分析仪(FlowCam)分析颗粒时,观察到不同的特征形态。然而,当在一个检查全面颗粒的基础上,颗粒激活补体的倾向不取决于颗粒的形态。值得注意的是,流动成像显微镜对具有微米级特征的颗粒形态特征很敏感。有可能在更精细的尺度上,不同颗粒类型中的蛋白质结构可能是相似的,因此每个颗粒的补体活化水平相似。
表面活性剂的微粒如PS20和聚山梨酯80已被证明能够激活补体。但在本例中,补体激活似乎并不强烈依赖于表面活性剂的浓度,因为添加PS20和不添加PS20的剂型之间颗粒剂量依赖性是无法区分的。
我们观察到的补体激活与小于10微米的颗粒浓度呈线性相关性。补体的激活也普遍存在于大颗粒(大于10微米)数量最高的样本中
(见图5),这些较大的颗粒在不同应力条件下的IVIg样品中被发现,但是其浓度比较小颗粒的2-
10微米大小的颗粒的相应浓度低大约一个数量级。因此,对于补体的激活是否依赖于大于10微米的颗粒,我们的实验并不能确定。有趣的是,更小的亚微米颗粒目前还没有在肠外给药的蛋白质产品有明确规定‘;国药典<
USP 787/788
>中描述的颗粒含量限制仅适用于大于10微米和大于25微米的颗粒。监测小于10微米的颗粒,可以洞察治疗蛋白制剂的潜在免疫原性和补体激活能力。
在将这些结果扩展到预测补体激活引起的药物不良反应时,应谨慎使用。由于遗传和后天因素的影响,补体激活的阈值和程度可能因患者而异,从而直接预测颗粒在体内的反应是有问题的。此外,体外试验中使用的无细胞血清可能低估了颗粒激活补体的能力;在全血中,B细胞的存在增加了患者对利妥昔单抗激活补体的敏感性。最后,纳米颗粒对补体的激活可能具有高度的物质特异性,并且由其他蛋白药物形成的颗粒,例如单克隆抗体,可能与IVIg中存在的多克隆抗体混合物中的颗粒行为不相似。
结论
我们观察到,在基于血清的体外试验中, IVIg制剂产生一次意外冻融就能产生足够数量的颗粒来激活补体。对于受应力样品中2-
10微米大小的颗粒,补体激活与颗粒浓度成正比,而对于相同样品中>10微米的颗粒,则没有观察到明显的关联性。活化补体的水平与多种应力产生的特定颗粒形态无相关性,也与配方中非离子表面活性剂的存在无相关性。虽然这些结果可能不是很容易对病人注射了其他单克隆抗体药物产品后产生的药物不良反应进行定量预测,明智的做法显然是采取措施来规范处理,存储和管理治疗蛋白质产品以减少颗粒物产生。重要的是需要监测10微米以下大小的微粒来洞察免疫原性。







