CRISPR触发的内源Oct4或Sox2基因位点染色质重塑激...(一)
CRISPR触发的内源Oct4或Sox2基因位点染色质重塑激活细胞重编程
题目:CRISPR-Based Chromatin Remodeling of the Endogenous Oct4 or Sox2 Locus Enables
Reprogramming to Pluripotency
期刊:Cell stem cell
影响因子:23.394
主要技术:CRISPR-dCas9-VP64激活系统、诱导性多能干细胞构建、原代细胞制作、iPS鉴定
研究背景
终末分化的成体细胞逆分化,形成多能干细胞状态的过程称为细胞重编程(Cell
reprogramming)。在2006年,日本科学家山中伸弥(Shinya Yamanaka)发表诱导性多能干细胞(iPS, induced
pluripotent stem cells)构建技术,利用逆转录病毒,把OSKM(OCT4, SOX2,KLF4 and
C-myc)四因子在体细胞中进行超表达,成功把小鼠胚胎成纤维细胞诱导形成多能干细胞,开辟了一个全新的干细胞研究领域。随着研究的深入,人皮肤成纤维细胞、T淋巴细胞等也被成功诱导成多能干细胞。而这些多能干细胞与供体DNA是保持一致的,且有分化成多种细胞的潜力,展现出非常广阔的临床应用前景。如把人血液中的T淋巴细胞逆分化形成多能干细胞后,当定向分化技术成熟时,
iPS能被有序分化成需要的细胞,比如心肌细胞、神经细胞等。
染色体上重要的基因启动子位点的表观遗传学变化,如DNA甲基化水平变化、组蛋白乙酰化水平变化、染色质重塑等,开启重要基因如OCT4, SOX2等的内源性表达,是iPS诱导过程中至关重要的事件,直接关系到诱导是否成功。
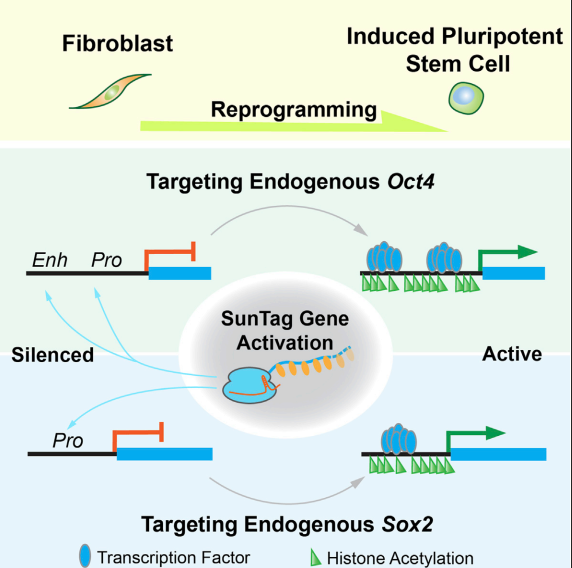
CRISPR-Cas9系统作为一种强大的基因编辑工具,现今已广泛用于常规的细胞或者个体的基因敲除、基因敲入、点突变外。当CAS9蛋白进行失活改造以及结构域添加后,得到CRISPR-dCas9-SunTag-VP64系统,则能实现特异基因转录激活。CRISPR-dCas9内源基因激活技术(SunTag Gene Activation),正好与iPS诱导技术完美契合,解决了激活内源OSKM四基因的问题,从而诞生了新型的iPS构建策略(见图1)。
图1. 利用CRIPR-dCas9基因激活系统的iPS诱导策略
研究内容及结果
1. 设计定位于Sox2和Oct4基因启动子区和Oct4增强子区的sgRNA,利用CRISPR-dCas9-SunTag-VP64对Sox2和Oct4进行激活。
本研究首先设计了相应基因靶标的SgRNA,启动子区或者增强子区靶标位置考虑因素包括:sgRNA靶标位置与重要的转录因子(OCT4、SOX2、NANOG)结合位点、组蛋白乙酰转移酶p300结合位点的距离,靶标区附近组蛋白乙酰化分布、DNA甲基化分布等。并以MEF细胞为材料,在RNA水平检测了不同sgRNA对靶标基因sox2和oct4的激活效果(图2)。
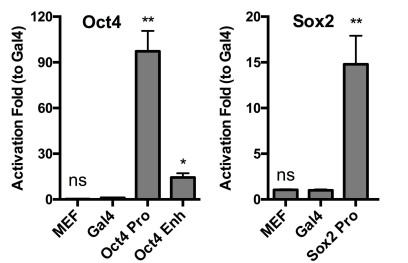
图 2. MEF细胞中,Sox2和Oct4基因启动子区和Oct4增强子区不同sgRNA的转录激活效果验证实验
2. CRISPR-dCas9-SunTag-VP64系统对重要基因进行内源激活,能成功获得iPS。
随后,同样使用此方法,利用筛选出来18个有效sgRNA,分别激活7个重要基因: Oct4, Sox2, Klf4, c-Myc,
Nr5a2, Glis 1, Cebpa。将MEF利用病毒感染方法进行18
sgRNA导入后,与dCas9-SunTag-VP64形成复合体,激活了OG2-MEF中相应内源基因的表达,经过17天的诱导后,成功得到了iPS细胞,并稳定传代,且显示出与胚胎干细胞相同的克隆形态。通过免疫荧光和QPCR,显示得到的iPS表达Nanog,
Sox2和SSEA-1,相关干细胞基因表达水平与RI胚胎干细胞相比,均相当或者超过。此部分证明CRISPR-dCas9-SunTag-VP64系统进行内源激活时,能成功实现iPS诱导(图3)。

图3. CRISPR-dCas9-SunTag-VP64系统同时激活Oct4, Sox2, Klf4, c-Myc, Nr5a2, Glis 1, Cebpa内源表达时,能成功实现iPS诱导