Nature:新研究揭示核小体结合导致cGAS失活的分子基础
在所有哺乳动物中,环状GMP-AMP合酶(cGAS)感知病原DNA的入侵,并刺激炎症信号转导、自噬和凋亡。cGAS都是通过检测处于错误位置的DNA来发挥作用的。在正常条件下,DNA被紧密地包装在细胞核中并受到保护。DNA没有理由会在细胞周围自由移动。当DNA片段确实最终逃离细胞核并进入细胞质中时,这通常表明存在着一些不祥之兆,比如来自细胞内的损伤或来自侵入细胞内的病毒或细菌的外来DNA。
cGAS蛋白通过识别这种处于错误位置的DNA而发挥作用。在正常情形下,它在细胞中处于休眠状态。但是一旦cGAS检测到DNA存在于细胞核外面,它就突然起作用。它产生另一种化学物质---一种被称作2'3'环状GMP-AMP(cGAMP)的第二种信使,从而引发一种分子链反应,结果就是提醒细胞中的DNA异常存在。在这种信号级联反应结束时,细胞要么得到修复,要么因损坏到无法修复的地步,它就会自我破坏。
但是细胞的健康和完整性取决于cGAS能够将无害的DNA和外来DNA或在细胞遭受损伤和应激期间释放出的自身DNA区分开来。
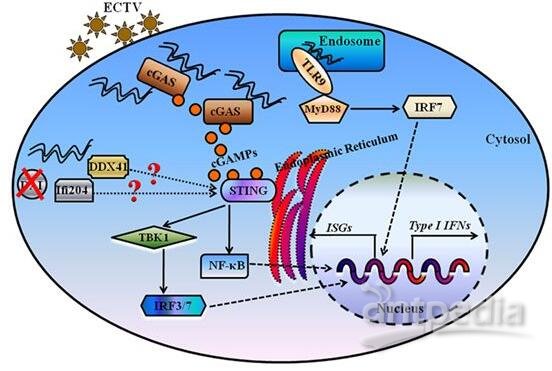
图片来自Frontiers in Immunology, 2018, doi:10.3389/fimmu.2018.01297。
病原体来源的核酸能诱导强有力的先天免疫反应。环状GMP-AMP合酶(cGAS)是一种双链DNA(dsDNA)传感蛋白,可催化合成环状二核苷酸cGAMP,所产生的cGAMP通过STING-TBK1-IRF3信号轴7-11介导I型干扰素的诱导。cGAS存在于细胞质中,它对自身DNA不具有反应性已被广泛接受。然而,近期的研究已表明,cGAS主要存在于细胞核中,紧密的核小体束缚让cGAS保持在非活性状态。
在一项新的研究中,来自美国德州农工大学的研究人员发现cGAS以纳米摩尔亲和力结合核小体,而且核小体结合强有力地抑制cGAS的催化活性。为了阐明核小体结合导致cGAS失活的分子基础,他们确定了小鼠cGAS与人核小体结合在一起时的低温电镜(cryo-EM)结构。相关研究结果于2020年9月10日在线发表在Nature期刊上,论文标题为“The Molecular Basis of Tight Nuclear Tethering and Inactivation of cGAS”。
这种结构表明cGAS通过它的第二DNA结合位点与组蛋白H2A和H2B形成的带负电的酸性口袋(acidic patch)结合。高亲和力的核小体结合阻止dsDNA结合,并使cGAS处于非活性构象。破坏核小体结合的cGAS突变极大地影响细胞中cGAS介导的信号转导。