固相时间分辨荧光免疫分析的标记技术及标记过程中...
本研究利用BCPDA进行固相TRF IA研究,它克服了解离增强体系需增强溶液、易受环境铕离子污染、只能液相测量等缺点,简化了测量步骤。结合BCPDA标记BSA,研究标记过程中的蛋白质含量测定。为TRF IA体系提供理论依据和实验技术 。材料和方法
1 材料
1. 1 仪器 分光光度计,核酸蛋白检测仪, 磁力搅拌器, pH22酸度计, 层析柱,凯氏定氮仪,半自动定氮仪 。
2. 2 试剂 BCPDA (自合成) , 99. 999%Eu2 03 (自制) ,牛血清白蛋白, SephadexG250葡聚糖, 三羟甲基胺基甲烷(超级纯) ,考马斯亮蓝G2250 ,无水碳酸钠和无水碳酸氢钠等试剂均为市售分析纯以上。相关缓冲溶液均自制。实验用水:去离子水。
2 方法
2. 1 标记反应 室温下,蛋白质在0. 1mol/LpH = 9. 1的碳酸盐缓冲液中衍生后,用二甲基甲酰胺(DMF)溶液将最新制备的BCPDA溶解,分几份以1min间隔加入,同时连续涡流旋转蛋白质溶液,室温搅拌30min反应结束。
2. 2 分离纯化 标记反应液中除有一部分BCPDA与蛋白质结合外,还存在游离状态的BCP2DA,将标记反应液通过凝胶层析柱,将结合的BCP2DA与游离 的BCPDA加以分离,第一峰为结合峰,第二峰为游离BCPDA峰。在核酸蛋白仪280nm监测下,收集结合峰部分的溶液。
2. 3 BCPDA标准溶液配制 称取一定量BCP2DA用DMF溶解,用pH = 7. 8 Tris2HCl缓冲溶液稀释成一定浓度,配制成BCPDA标准溶液,备用。
2. 4 溶液中BCPDA含量测定 ①利用BCPDA在325nm的特征吸收,其消光系数为1. 5 ×104mol/L-1 ·m-1 ,计算BCPDA的浓度,公式为: BCPDA浓度(C) =吸光度(A) / (比色皿厚度×消光系数) ×稀释倍数,本实验中: C = A / (25px ×1. 5 ×104mol/L-1m-1) ×稀释倍数; ②将BCPDA标准溶液分别用pH= 9. 1 碳酸盐缓冲液, pH = 8. 0 NH4HCO3 缓冲液,pH = 7. 8 Tris2HCl缓冲液稀释至不同浓度,置25px ×25px石英吸收池测其在325 nm处A值,做出工作曲线。同法测定样品,在对应工作曲线上查出样品中的BCPDA浓度。
2. 5 BSA标准溶液配制 称取一定量BSA用乙醇溶解,用pH = 9. 1的碳酸盐缓冲溶液稀释成一定浓度,备用。
2. 6 考马斯亮蓝染色剂配制 称取0. 020g考马斯亮蓝G2250溶于95% 10mL 乙醇,加85%磷酸20mL,加去离子水稀释至200mL 。
2. 7 考马斯亮蓝染色法BSA标准溶液配制 取不同体积的BSA标准蛋白溶液, 分别加入10mL 容量瓶,用Tris2HCl缓冲液加到1mL,加染色液定容至刻度,立即摇匀,室温放置10min,测595nm吸光度。
2. 8 考马斯亮蓝染色法BSA—BCPDA溶液配制 从反应瓶中取一定量反应液至5mL 容量瓶,加Tris2HCl缓冲液到1mL,再加入考马斯亮蓝G2250染色液到刻度,室温放置10分钟,测595nm吸光度。
结果与讨论
1 BSA的吸收光谱性质
分别用pH = 9. 1 碳酸盐缓冲液, pH = 8. 0NH4HCO3 缓冲液, pH = 7. 8 Tris2HCl缓冲液分别将BSA储备液稀释至不同浓度,置25px ×25px石英池测其在280nm处吸光值。三种缓冲液稀释BSA吸光值与其浓度(1028 ~1026 mol/L)之间呈良好线性关系。
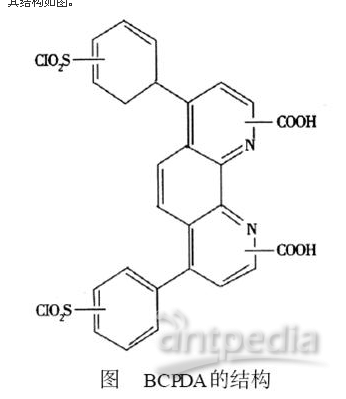
2 BCPDA的结构
从BCPDA 的结构上看,它含有两个磺酰氯基团,可在温和条件下与蛋白质的游离氨基共价结合。它含有的异芳香基氮和两个羧基共同构成了与铕离子螯合的部位。以 BCPDA2Eu3 +螯合物标记蛋白质形成了性质十分稳定的荧光螯合物,经紫外光激发能够产生具有较高量子产率、较大Stokes位移、较窄发射谱带、较长荧光寿命( 10~1000μs)的荧光。其结构如图。
3 BCPDA的吸收光谱
将BCPDA标准溶液分别用pH = 9. 1碳酸盐缓冲液, pH = 8. 0 NH4HCO3 缓冲液, pH = 7. 8 Tris2HCl缓冲液稀释至不同浓度,置25px ×25px石英吸收池测其在280、325 nm A 值,三种缓冲液稀释的BCPDA与其浓度(1026 ~1024 mol/L)之间呈良好线性关系,主要吸收光谱峰为232. 95、291. 58、325. 04nm。
4 BCPDA在280 nm处吸收干扰BSA测定
蛋白质含量测定在TRFIA标记实验中涉及到标记比的计算,监测标记反应过程,标记条件控制,因此蛋白含量的测定及其准确性、灵敏性尤为重 要。液相TRF IA 体系应用EDTA 等双功能螯合剂在280nm 处并未干扰蛋白质的特征吸收, 可采用280nm处紫外吸收法测定蛋白质含量。而在新型双功能螯合剂BCPDA 基础上建立起来的固相体系,BCPDA与蛋白质均在280nm处有较强吸收,这是因为蛋白质在280nm处的特征吸收缘于水解生成的大量氨基酸及苯环结 构,而从BCPDA的分子结构式来看同样存在苯环结构并含羧基,所以紫外吸收法测定蛋白质含量并不适用固相体系。
5 考马斯亮蓝G2250染色法测蛋白质含量对比实验
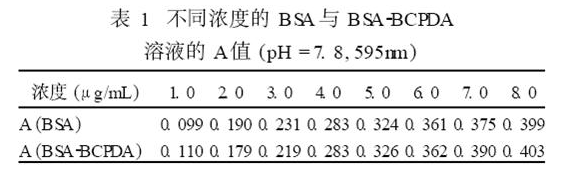
将同样浓度BSA标准溶液和BSA2BCPDA 标记反应液用考马斯亮蓝G2250 染色法测蛋白质含量,对比实验结果如表1。结果表明,在1. 0~8. 0μg/mL浓度范围内,BCPDA未干扰BSA测定。
实验也在5. 0~40μg/mL浓度范围内进行了研究,BSA 与BSA2BCPDA 溶液的A 值具有较好的一致性,符合比尔定律,满足标记监测要求。
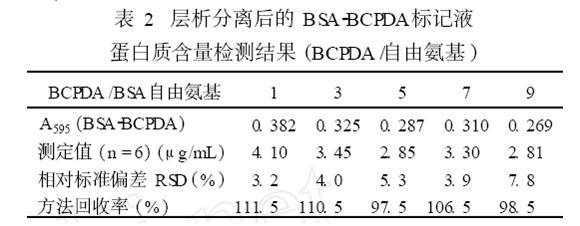
6 层析后的BSA2BCPDA标记液蛋白质含量检测从所收集的纯化反应液中,用考马斯亮蓝法检测,并与BSA标准溶液的标准曲线对照,查出相应蛋白质含量, 计算回收总量。实验测定了不同样品(BCPDA /自由氨基)的BSA2BCPDA中BSA含量,结果如表2。
7 缓冲溶液选择
实验比较了用pH = 7. 8 Tris2HCl、pH = 9. 1NH4HCO3、pH = 9. 1碳酸盐、pH = 8. 0 NH4HCO3 缓冲液作为测定溶剂体系,发现使用pH = 7. 8 Tris2HCl缓冲溶液的工作曲线线性好于后三者。
8 相关样品参数
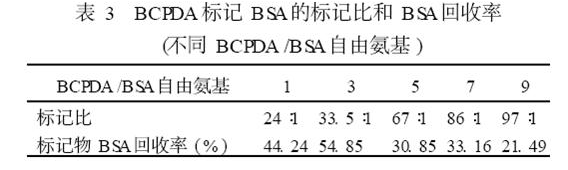
实验测定了用1. 125px ×625px 层析柱, 不同(BCPDA /BSA自由氨基) 投料比的标记物标记比(BSA mol/BCPDA mol)和BSA 回收率(% ) (见表3) 。BCPDA 标记BSA 反应最高蛋白质回收率为54. 85%,初步推测标记比随BCPDA量增加而增大。
9 BCPDA2BSA2 Eu3 +的螯合反应及荧光光谱
将一定浓度的BCPDA2BSA液中加入含有Eu3 +的Tris2HCl缓冲液,按一定倍数稀释,于37℃恒温育0. 522h,使BCPDA与Eu3 +发生螯合反应,室温稳定1h后用337. 1nm 激发,可测得铕离子荧光特征峰589、611nm。
结 论
( 1)紫外吸收法不适合固相TRFIA 体系BSA2BCPDA中蛋白质的测定。
(2)实验研究了在1027 ~1025 mol/L BCPDA标准溶液中加入适量考马斯亮蓝染色液时, 595 nm处未见明显吸收。
(3)用考马斯亮蓝G2250染色法测定BSA2BCPDA中的BSA,在本实验条件下,工作曲线范围为0. 50~40. 0μg/mL,曲线回归方程为: Y =0. 00032 +0. 0015X, r=0. 9996。检测下限以3σ/ r计算,为0. 35μg/mL ( n =9) , RSD <7. 8% 。该法操作简便迅速,具有消耗样品量少,干扰程度小,灵敏性高等优点。 (4)将考马斯亮蓝染色法用于固相TRF IA标记物中蛋白质测定,对多苯环螯合物、配位体与蛋白质连接研究具有一定意义。




















