PNAS:基因编辑时阻止基因组不稳定的CRISPR-BEST技术
尽管CRISPR技术允许对基因组进行更好的操纵,并对现代药物开发和更好的新型抗生素的发现产生许多积极影响,但是当使用该技术时,仍然存在诸如基因组不稳定和Cas9蛋白毒性等重大问题。
不过,在一项新的研究中,来自丹麦技术大学的研究人员开发出一种称为CRISPR-BEST的新工具,它有望成为CRISPR工具箱中的新成员。这种工具可以在不需要引入DNA双链断裂的情况下高效地在放线菌中产生突变。相关研究结果近期发表在PNAS期刊上,论文标题为“Highly efficient DSB-free base editing for streptomycetes with CRISPR-BEST”。
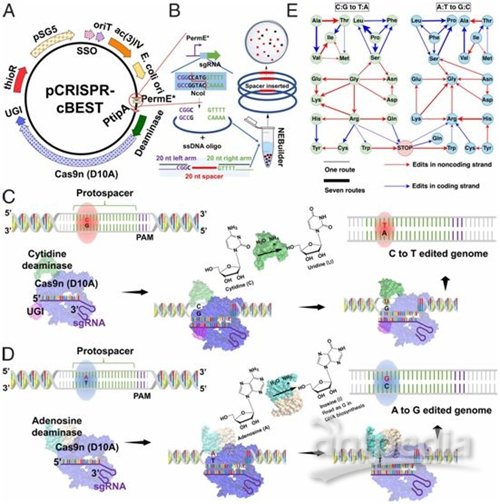
CRISPR-BEST的原理和工作流程,图片来自PNAS, 2019, doi:10.1073/pnas.1913493116。
因此,CRISPR-BEST系统解决了放线菌基因工程所面临的一项重大挑战,这是因为引入DNA双链断裂经常导致基因组不稳定,这就迫使放线菌发生重排,或者甚至剔除较大的染色体片段---这是当对细胞进行基因改造以便产生物活性化合物和新型抗生素时想要避免的一种现象。
论文第一作者、丹麦技术大学诺和诺德基金会生物可持续性研究中心研究员Yaojun Tong说,“CRISPR-BEST解决了与当前CRISPR技术相关的一些主要问题。这可能是朝更好地利用诸如基因操纵和基因编辑之类的生物技术的潜力而迈出的一大步。”
两全其美
开发CRISPR-BEST的想法来自于这些研究人员想要使用常规的CRISPR方法来让一个特定基因失活以便产生抗生素黄色霉素(kirromycin)的新变体。但是,在这些实验中,他们丢失了细菌染色体的绝大部分---总共丢失了130万个碱基对,而不是仅让所需的基因失活,而且这种染色体大片段丢失可能是CRISPR切割染色体所导致的。因此,他们开始寻找提高CRISPR编辑效率但同时避免切割染色体的方法。
为此,他们开发出CRISPR-BEST系统。他们认为CRISPR-BEST是实现这种两全其美的一次成功尝试。
论文通讯作者、丹麦技术大学诺和诺德基金会生物可持续性研究中心的Tilmann Weber教授说,“我们维持了CRISPR的编辑效率,这允许我们能够非常容易地靶向感兴趣的基因。但是,在另一方面,我们如今能使用非常温和的条件来引入突变,所引入的突变将给细胞带来更少的压力,因而避免了我们构建出的产生抗生素的细菌出现基因组不稳定的问题。”
进一步优化
CRISPR-BEST是朝着正确方向迈出的重要第一步,不过这些研究人员目前正在研究如何进一步提高编辑效率并增加可以同时进行的基因组编辑数量。这些技术进展可能与使用可以处理大量样本的机器人携手并进,这将为在未来进行大量基因组编辑铺平了道路。
Tong说,“放线菌是抗生素和其他生物活性化合物的最佳生产者之一。对放线菌系统性代谢工程而言,仅有少量基因工具具有统性代谢工程方法所需的高通量和可扩展性---因此仅凭我们如今有了一种新工具的这一事实而言,这已经就是一个优势。”





















