肌肉干细胞研究最新进展
肌肉干细胞可发育分化为成肌细胞(myoblasts),后者可互相融合成为多核的肌纤维,形成骨骼肌最基本的结构。
人类胚胎和成人体内都存在肌肉干细胞。胚胎和胎儿的肌肉干细胞增殖使得肌肉组织发展;成年人体内的肌肉干细胞亦被称为卫星细胞,处于休眠状态,沿着肌肉纤维而分布。在经过强烈运动或是受到外界伤害之后,成人的肌肉干细胞会被激活并开始自我增殖,从而增加或是恢复成人的肌肉组织。对于老年人,肌肉干细胞不再具有自我复制的活性,从而表现为肌肉组织的萎缩。
小编针对近年来肌肉干细胞研究取得的进展进行一番盘点,以飨读者。
1.Nat Metab:衰老肌肉细胞为何愈合能力下降?
doi:10.1038/s42255-019-0110-3
来自卡耐基大学的生物学家Chen-Ming Fan领导的一项研究表明,随着年龄的增长,肌肉损伤的恢复能力的下降是由一种蛋白质介导的。该蛋白质能够抑制肌肉干细胞分化形成新肌肉组织的能力。相关结果发表在最近的Nature Metabolism。
骨骼肌中的肌肉干细胞具有制造新肌肉组织的强大能力。这些细胞不仅擅长“制造”肌肉,而且还可以不断分裂产生更多的干细胞,这一过程称为“自我更新”。但是它们的相关能力会随着年龄的增长而减弱,从而导致肌肉创伤后的再生能力下降。
最近,来自卡内基大学的研究者们发现一种叫做GAS1的蛋白质是导致这种情况的罪魁祸首。作者解释说:“ GAS1蛋白由生长抑制特异性基因编码,它介导了衰老导致的肌肉干细胞的功能衰退。”
他们发现,这种蛋白质大量表达于所有老化的肌肉干细胞中。人为从从衰老的肌肉干细胞中去除GAS1可使它们恢复年轻状态,从而支持强大的再生能力。他们还发现,GAS1抑制了另一种称为RET的细胞表面受体,而后者对于肌肉干细胞的更新是必需的。相应的,GAS1蛋白越多,RET的功能就越降低。GAS1对RET的抑制作用可以被第三种称为GDNF的蛋白逆转,该蛋白能够结合并激活RET。当研究人员将GDNF直接注射到衰老小鼠的肌肉中时,肌肉干细胞功能和肌肉再生得以恢复。
2. Mol Ther:CRISPR-Cas9技术能够治疗杜氏肌营养不良
doi:10.1016/j.ymthe.2019.06.012
杜氏肌营养不良症(DMD)是一种罕见但十分严重的遗传性疾病,可导致肌肉的流失与机体的损伤。最近,由密苏里大学医学院的研究人员作出的一项研究表明:基因编辑技术CRISPR可以为纠正导致该疾病发生的基因突变提供终生性的手段。
“基于动物模型的研究表明,CRISPR可用于纠正导致肌肉细胞异常死亡的基因突变,”该文章的资深作者Dongsheng Duan博士说到:“然而,由于这些基因编辑的肌肉细胞会随着时间的推移而逐渐老去。因此,如果我们可以纠正肌肉干细胞中的相关突变,那么再生的肌肉细胞将不再携带该突变。”
首先,研究人员通过AAV9向正常小鼠肌肉注入基因编辑载体。 “我们将AAV9处理的肌肉移植到免疫缺陷的小鼠体内。移植的成年肌肉细胞会率先死亡,然后干细胞中再生新生的肌肉细胞。如果干细胞能够被成功编辑,那么再生的肌肉细胞也应携带编辑的基因。”
研究人员的推理是正确的,因为他们在再生肌肉中发现了大量的,已经经过编辑细胞。并且这些细胞能够正常产生dystrophin蛋白。
3.Cell Rep:研究人员揭示女性更年期肌肉萎缩的原因
doi:10.1016/j.celrep.2019.06.025
在最近发表在《Cell Reports》的一篇文章,明尼苏达大学医学院康复医学系教授Dawn Lowe博士首次确定了雌激素对女性肌肉干细胞的维持和功能是必不可少的。
这项研究调查了通过手术切除卵巢的小鼠以及肌肉干细胞中没有雌激素受体的小鼠,并评估了肌肉再生的能力。研究发现,肌肉干细胞中雌激素的缺失或雌激素受体的基因缺失导致5块不同肌肉中的肌肉干细胞(也称为卫星细胞)数量下降30%-60%。存活的细胞在受伤后很难自我繁殖和生成新的肌肉。这项研究还包括与芬兰科学家的合作,他们对绝经前后的女性进行了肌肉活检。研究结果显示,在人类中,卫星细胞的数量与血清雌激素水平的变化密切相关。"这是第一个表明雌激素缺乏会影响卫星细胞数量和功能的研究,"lowe说。
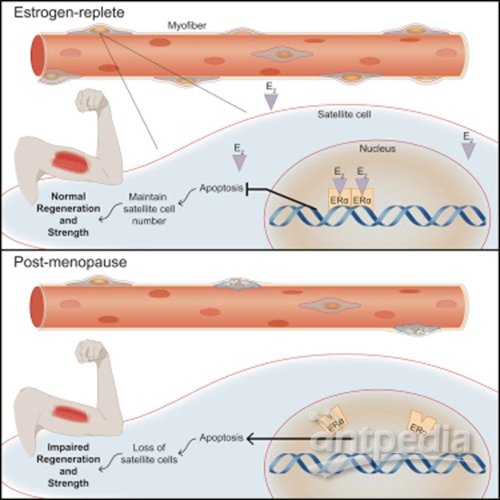
图片来源:Cell Reports。
众所周知,更年期症状的雌激素替代疗法可以帮助维持肌肉健康。但是这种治疗肌肉衰弱的激素替代疗法也会增加由于雌激素对组织(如乳房和子宫内膜)的影响而患癌症的风险。研究团队发现了一个新的药物,该药物可以与已知的雌激素受体以一种不影响乳房或子宫内膜组织的方式相互作用,这种药物能够刺激肌肉干细胞中的雌激素信号,因此可能可以防止衰老女性由于更年期导致的肌肉干细胞下降,这种药物治疗不会产生与常规激素替代疗法相似的风险。
4.Gene Dev:新研究揭示肌肉干细胞分化的“震荡”效应
doi:10.1101/gad.322818.118
当肌肉受伤时,肌肉干细胞必须随时准备好开始“行动”:例如,在体育活动期间,他们有责任尽快分化产生新的肌肉细胞。然而,与此同时,身体需要有一种机制可以阻止干细胞的不受控制的分化 -否则这些细胞在肌肉中的供应会迅速耗尽。根据研究小组最近在《Genes&Development》杂志上的报道,MyoD和Hes1蛋白调节肌肉干细胞的分化,导致产生的细胞数量存在周期性波动。
“在我们的实验中,我们首先将Hes1和MyoD连接到蛋白质上,发光 -即发光 -蛋白质,以便我们更好地跟踪它们的发育,”该研究的主要作者Ines Lahmann博士解释道。然后,研究小组能够观察到 -在分离的细胞,肌肉组织和活体动物中 -作为Notch信号通路的一部分的Hes1蛋白以振荡方式产生。
“生产每两到三个小时达到高峰,然后再次下降,”Lahmann报告说,他们在MyoD蛋白中遇到了同样的现象。 “只要干细胞中MyoD的数量周期性波动,细胞就会生长和分裂,从而自我更新”。
5.PNAS:细胞替代疗法可用于治疗肌营养不良症
doi:10.1073/pnas.1808303116
明尼苏达大学医学院最近一项研究为利用细胞疗法治疗肌营养不良带来了新的希望。在这一发表在美国国家科学院院刊(PNAS)上的研究中,作者深入地研究了体外产生的细胞如何达到肌肉再生的目的。
多年来,研究者们率先在体外从多能干细胞培养分化产生肌肉干/祖细胞。这些细胞在移植到患有肌营养不良症的小鼠后能够产生新的功能性肌肉。如今,研究人员已经推进了这些研究结果,首次确定了培养皿中产生的肌肉干细胞的分子特征。
“我们早就已经知道知道肌肉干细胞在移植之后会发育产生新的肌肉细胞,但对组织环境在这一过程中的影响并不清楚。对此,我们这一研究了解了环境起着的具体作用,这是一个令人兴奋的发现,”作者说到。 “在分子和功能水平上了解移植后这些细胞发生的变化,对于为未来的治疗应用提供理论基础尤为重要。”
6.Cell Rep:肌肉干细胞也能够驱动癌症的发生?
doi:10.1016/j.celrep.2018.12.089
患有杜氏肌营养不良症(DMD)的人有时会发展出一种罕见的肌肉癌,称为横纹肌肉瘤,这是由于肌细胞不断努力重建受损组织导致的。然而,人们对这种癌症是如何产生的知之甚少,因此阻碍了癌症风险预测、治疗或检测的发展。
现在,Sanford Burnham Prebys医学发现研究所(SBP)的科学家已经证明,肌肉干细胞可能会导致DMD期间发生的横纹肌肉瘤,并确定了与肿瘤生长相关的两个基因。这项使用严重DMD小鼠模型进行的研究有助于科学家更好地了解横纹肌肉瘤在DMD中的发展情况,并表明正在开发的刺激肌肉干细胞治疗的努力应考虑潜在的癌症风险。该研究于2019年1月15日发表在Cell Reports上。
图片来源:Sanford Burnham Prebys Medical Discovery Institute (SBP)。
在这项研究中,科学家们发现,患有更严重DMD的小鼠更早发生了横纹肌肉瘤,这表明增加的肌肉退化促进了癌症的发展。接下来,他们从患有严重DMD的小鼠中分离出几个参与肌肉再生的细胞,并测试了它们成为肿瘤的能力。与其他细胞相比,肌肉干细胞在独立生长时具有增强的复制能力(自我更新)和形成的肿瘤。肌肉干细胞也显示出它们会发展成肿瘤的早期迹象,包括增加的自我更新,DNA损伤的积累和类似于人横纹肌肉瘤中所见的基因表达模式。
利用RNA测序,科学家们还发现了与肿瘤生长相关的两个基因Ccl11和Rgs5,这些基因与炎症和伤口愈合有关。当科学家们将Ccl11和Rgs5蛋白质添加到肿瘤细胞中时,它会减少它们的生长 -这表明这些基因参与了癌症的生长。
7.Cell Stem Cell:研究人员发现控制干细胞分化的药物!干细胞疗法或将终结肌肉萎缩症!
doi:10.1016/j.stem.2017.12.010
一个由UBC研究人员一起创造的药物也许可以克服干细胞治疗面临的主要挑战之一——干细胞可能会太早及太快分化变成特定的组织细胞。如果这个药物可以像在实验室小鼠身上那样发挥作用的话,也许将使干细胞疗法更接近现实。
UBC和斯坦福大学的研究人员对于使用干细胞辅助肌肉组织再生治疗肌肉萎缩症很感兴趣,肌肉萎缩症是一种遗传疾病,病人肌肉会随时间而受损变弱。干细胞具有分化产生组成人体特定组织的新细胞,因此具有治愈这类疾病的潜力。理论上,干细胞可以产生新组织替代受损的组织。但是科学家们却鲜有成功,尤其是对于肌肉,因为干细胞一旦从实验室培养皿中分离出来就开始分化,不再是干细胞。就肌肉萎缩症而言,肌肉干细胞会停止分裂、分化形成肌纤维,而肌纤维的移植效果并不好。
研究人员发现一个叫做Setd7的蛋白在控制干细胞生长以及分化为肌纤维过程中发挥关键作用。通过一个药物,他们可以抑制Setd7蛋白,防止干细胞分化,这样干细胞就会不断分裂。随后他们将干细胞移植到肌肉萎缩症小鼠模型的后腿上,发现这些细胞与肌肉很好地融合在一起,再生组织并提高了肌肉的强度。
“这项发现揭示了一种增强肌肉干细胞治疗效果的新方法,这种方法允许这些细胞在移植到受损组织后促进组织再生并改善肌肉功能。”研究第一作者、UBC博士后研究员、STEMCELL科技资深科学家Robert Judson说道。
8.Nat Commun:iPS技术帮助科学家们成功将皮肤细胞转化为骨骼肌组织
doi:10.1038/s41467-017-02636-4
最近,生物医学工程师们利用诱导多能性干细胞技术成功地培育出了功能性的人源骨骼肌细胞。这项研究是建立在2015年的一项研究成果的基础上。当时杜克大学的研究者每年首次利用肌肉样本培育出了功能性的骨骼肌组织。而最近的这项研究则利用了非肌肉组织进行转化。该方法使得基因编辑用于细胞治疗更近了一步。相关结果发表在最近一期的《Nature Communications》杂志上。
在这项研究中,作者首先分离了成年人的分肌肉组织,例如皮肤或者血液,并且通过重编程的技术将其转化为初生状态。多能性干细胞进一步在有Pax7的刺激下培养,该分子能够释放信号将初生组织转化为肌肉组织。随着细胞的不断增殖,其形态变得与成体肌肉干细胞十分相似,只是致密程度哺乳后者。虽然此前研究也有类似的进展,但从没有人成功地将这些中间体最终转化为成熟的,有功能的骨骼肌。一旦细胞开始向肌肉的方向顺利分化,作者等人立即停止了Pax7的刺激,并且给细胞以充足的养分,以帮助其能够最终走向成熟。
在这项研究中,作者等人发现在经历了2-4周的3D培养之后,肌肉细胞开始形成肌纤维,并且在外界刺激,例如电信号或化学信号,的作用下能够成功收缩。之后,他们还将这些新生成的肌纤维移植进入小鼠体内,结果表明这些细胞能够最终存活而且通过血管生成的方式与内部组织相连,并且行使至少三周的功能。
9.Cell Stem Cell:科学家利用畸胎瘤成功衍生出肌肉干细胞
doi:10.1016/j.stem.2018.06.010
近日,来自明尼苏达大学医学院的科学家们通过研究开发了一种新方法,能通过名为畸胎瘤的良性肿瘤为肌营养不良症的小鼠机体再生骨骼肌细胞,相关研究刊登于国际杂志Cell Stem Cell上。
文章中,研究人员描述了他们如何寻找细胞来源来重新制造骨骼肌;Michael Kyba教授说道,这项研究中我们旨在通过搜索未被科学家们探索的地方来寻找合适的细胞来源,当特殊细胞被移植后其就能再生骨骼肌,同时文章中我们也发现这种新生的骨骼肌在力量和弹性方面能发生显著的改善。
研究人员对来自动物畸胎瘤中的细胞进行靶向作用,结果发现,通过对畸胎瘤细胞进行提纯分类,就能为肌营养不良症的小鼠再造骨骼肌,畸胎瘤是一种特殊类型的肿瘤,其能产生所有类型的细胞,包括腺体细胞和毛囊细胞等。研究人员表示,他们并未研究自发产生的病例性畸胎瘤。
相反,研究人员利用未分化的多能细胞注入到免疫缺陷的小鼠机体中制造出了畸胎瘤,同时他们发现,除了含有多种细胞类型,畸胎瘤中还含有大量的肌肉干细胞。研究结果表明,利用这些畸胎瘤中的干细胞能够有效分化再生出骨骼肌细胞,而细胞分化再生的潜力超过了研究人员之前的想象,随后研究者将一小部分畸胎瘤衍生细胞注射到患病肌肉中,结果发现,相比当前方法所产生的5%-10%的再生率而言,畸胎瘤中细胞的再生率能达到80%,此外,畸胎瘤衍生细胞还能填充成为含有肌肉干细胞的新生肌肉。
指示肌肉功能的其它参数包括强直力、比力和疲劳时间等,利用畸胎瘤产生的肌肉在肌肉功能控制上表现出了明显的改善。当前的研究结果非常有前景,研究人员指出,这项研究的关键就在于,与目前疗法相比,这些畸胎瘤细胞具有产生有再生潜力细胞的能力,尽管这些新生的肌肉组织并没有表现出任何畸胎瘤的迹象,也并未出现任何其它不良事件,但研究人员认为,在考虑治疗应用之前首先确保这种方法的安全性是最重要的。
10.JCI Insight:洗清冤屈!“坏蛋白”TAK1或许能促进机体肌肉生长!
doi:10.1172/jci.insight.98441
近日,一项刊登在国际杂志JCI Insight上的研究报告中,来自路易斯维尔大学的研究人员通过研究揭示了特殊分子在维持肌肉健康上所扮演的关键角色;当研究人员深入研究肌肉生长和健康的机制时,他们就发现了名为TAK1信号蛋白的特殊角色,TAK1即为转化生长因子β激活激酶1,由于TAK1能够激活和肌肉萎缩相关的通路表达,因此其对于肌肉健康是有害的。
Ashok Kumar博士表示,TAK1是机体中的一种非常重要的分子,其几乎能够调节所有类型的细胞,而且会参与到机体中许多信号过程中,同时还扮演着许多生理性角色,但TAK1在骨骼肌中的角色目前研究人员并不清楚。文章中,研究者假设,通过移除TAK1是否能够减缓肌肉萎缩(单一动作)相关的两种下游通路所产生的负面效应,研究人员设计了一系列细胞培养物和动物模型实验来确定是否移除TAK1就能够保留肌肉量和肌肉强度。
研究人员对TAK1进行研究的第一个线索就是对小鼠进行遗传化修饰移除骨骼肌中的TAK1,结果发现,这些小鼠在出生后不久全都会死亡;转变策略后,研究人员就开始对成年小鼠进行研究,他们发现,在成年小鼠机体中,代替增加肌肉量的话,降低TAK1的水平就能导致小鼠出现严重的肌肉萎缩,同时小鼠肌肉细胞的线粒体和氧化性压力还会出现异常,这些改变常常与肌萎缩侧索硬化症、2型糖尿病、癌症及老化患者机体肌肉的表现相一致。
11.Nature子刊:巨噬细胞有助让衰老的肌肉焕发青春
doi:10.1038/s41551-018-0290-2
许多退行性肌肉疾病直到成年时才会出现,并且在实验室中培养肌肉来测试这些患者的药物反应将受益于患者自身的成体细胞的使用。不过还存在着一个问题:实验室制造的成体肌肉组织不具有与新生儿组织相同的再生潜力。
在一项新的研究中,在添加多种已知有助肌肉修复的药物和生长因子遭遇失败后,Bursac实验室的前博士生Mark Juhas考虑加入一种对肌肉损伤作出反应并激活肌肉再生的支持细胞(supporting cell)群体。
在肌肉遭受损伤后,一类巨噬细胞出现在现场,清除留下的破坏,增加炎症和激活免疫系统的其他部分。它们招募的细胞之一就是另一类被称作M2的巨噬细胞,它们降低炎症和促进组织修复。尽管这些抗炎性巨噬细胞在此之前已用于修复肌肉损伤的治疗当中,但是它们从未被整合到在体外培养复杂的肌肉组织的平台中。
当这些研究人员利用一种毒素破坏成体衍生的工程肌肉时,他们没有观察到这种工程肌肉发生功能性愈合,而且肌纤维也无法再生。但是,当他们将这些抗炎性巨噬细胞添加到这种工程肌肉中时,他们发现它在15天内愈合损伤,并且几乎像损伤出现之前一样收缩。
这种成功似乎主要源于这些巨噬细胞起着阻止受损的肌肉细胞发生凋亡。与新生儿的肌肉细胞不同的是,成体肌肉细胞需要这些巨噬细胞来协助它们在不进入细胞死亡的情况下修复初始的损伤。随后,这些存活下来的肌纤维为肌肉干细胞提供“支架”,从而持续执行它们的再生功能。Bursac认为这一发现可能会为潜在的再生疗法提供一种新的研究方向。