中科院、上海交大Nature子刊发表免疫新成果
来自中科院生物物理研究所、上海交通大学的研究人员证实,IRTKS通过PCBP2 SUMO化 (SUMOylation)介导的MAVS降解负向调控了抗病毒免疫。这一研究发现发布在9月8日的《自然通讯》(Nature Communications)杂志上。
中科院生物物理研究所范祖森(Zusen Fan)研究员和上海交通大学的韩泽广(Ze-Guang Han)教授是这篇论文的共同通讯作者。
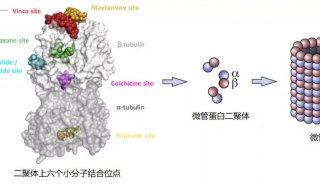
先天免疫是宿主对抗入侵微生物的第一道防线。先天免疫系统利用了生殖系编码(germline-encoded)的模式识别受体(PRR),包括膜结合Toll样受体(TLRs)和RIG-I样受体(RLRs)来检测外源病原体入侵。宿主PRRs3可以识别源自细菌和病毒元件的病原相关分子模式(PAMP)。所有的RLRs都包含一个DEAD/H-box RNA解螺旋酶结构域与dsRNA结合。RNA病毒感染的感应蛋白RIG-I和MDA5包含一个N-端串联CARD结构域,这一结构域对于启动I型干扰素(IFN)分泌至关重要。一旦与病毒RNA结合,RIG-I和MDA5会发生构象改变激活另一个接头蛋白:线粒体抗病毒信号蛋白(MAVS,也称作为VISA, IPS-1和CARDIF)。随后MAVS激活IRF3和NF-κB生成I型IFNs和其他的细胞因子,进一步激活适应性免疫并限制感染。
为了让宿主免于过度炎症造成的损伤,需要严格调控抗病毒信号清除侵入病原体。鉴于MAVS协调了来自两个独立中心PRRs的信号,细胞利用了各种机制来调节MAVS,包括蛋白质间互作,改变线粒体动态及翻译后修饰。近期,又报道了一些MAVS的负调控因子。其中,宿主RNA结合蛋白PCBP2最初被确定与宿主细胞mRNA稳定性和细胞mRNAs翻译调控有关。在病毒感染过程中,PCBP2可以结合MAVS,促进了AIP4介导的MAVS1降解。内源性PCBP2主要定位在细胞核中,但在病毒感染时它可以重定位于细胞质中启动MAVS降解。
IRSp53/MIM家族成员IRTKS在质膜突起形成中起着至关重要的作用。有研究报告,IRTKS直接介导了肌动蛋白丝(actin filament)聚集,启动了细菌感染时病原体驱动的肌动蛋白基座(pedestal)形成。此外,IRTKS还可以响应胰岛素刺激磷酸化。IRTKS缺陷可导致胰岛素耐受。而胰岛素耐受有可能与一些临床感染和免疫调控有关。然而目前对于IRTKS是否参与调控了先天免疫仍不清楚。
在这篇文章中,研究人员证实IRTKS缺陷可增强对RNA病毒的先天免疫反应。IRTKS介导对抗病毒感染的抑制依赖于RIG-I-MAVS信号通路。在病毒感染过程中IRTKS招募E2连接酶SUMO化细胞核中的PCBP2,导致PCBP2易位到细胞质。SUMO化的PCBP2与MAVS结合启动了它降解,导致了抗病毒反应下调。
由此,新研究证实IRTKS充当了过度炎症的一个负调控因子。
-
焦点事件