中大学子与学术牛人解析RNA修饰与癌症干细胞
N6-methyladenosine(m6A)是真核生物mRNA上最常见的一种转录后修饰,这种可逆的RNA甲基化修饰与人类疾病有关。研究者们已经陆续定位了哺乳动物转录组中的m6A,鉴定了这种动态修饰所需的“读”、“写”和“擦除”蛋白。不过,人们还对m6A起到的具体作用还知之甚少。
约翰霍普金斯大学和中山大学的研究人员发现,低氧条件通过m6A去甲基化诱导乳腺癌干细胞表型。这项研究发表在三月二十一日的美国国家科学院院刊PNAS杂志上,通讯作者是约翰霍普金斯大学医学院的著名学者Gregg Semenza教授。中山大学第一附属医院的Chuanzhao Zhang是这篇文章的第一作者。
Gregg Semenza博士是美国科学院院士, 中国科学院爱因斯坦讲席教授,目前担任美国约翰霍普金斯大学医学院的Michael Armstrong 教授。 1992年因发现低氧诱导因子(HIF1) 而成为现代低氧研究的奠基人。因为低氧及氧化应激反应是许多重要疾病的病理、生理基础,他的工作对肿瘤学及心血管疾病等的研究产生了重要的影响。他发表了270 多篇论文, 被引用了40,000多次。2010年 Semenza 博士获得了被称为Nobel医学奖风向标的Gairdner 国际医学奖,2012年当选为中国科学院爱因斯坦讲席教授。
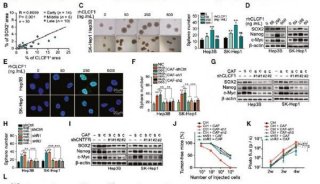
低氧是肿瘤微环境的一个关键特征。研究人员发现,这种条件会刺激乳腺癌细胞,促进依赖低氧诱导因子HIF-1α和 HIF-2α的ALKBH5表达。ALKBH5是一种去甲基化酶,能够去除NANOG mRNA上的m6A。已知多能性因子NANOG对于癌症干细胞的维持非常关键,这些细胞可以通过自我更新和分化,启动并维持癌症的发展。癌症干细胞相当于是癌症的“种子”,不仅能支持肿瘤的生长,还会促使癌转移和复发。
研究显示,ALKBH5过表达会减少NANOG mRNA上的m6A,通过稳定mRNA提高NANOG的水平,最终增加乳腺癌干细胞所占的比例。抑制ALKBH5的表达能减少乳腺癌干细胞的数量,降低了它们催生肿瘤的能力。这项研究表明,抑制ALKBH5或低氧诱导因子有望成为治疗乳腺癌的新途径。
m6A甲基化非常普遍,出现频率大约是3-5个残基/mRNA。最近中科院北京基因组研究所的研究团队在Molecular Cell杂志上发表文章,阐明了m6A及其结合蛋白YTHDC1在pre-mRNA剪切中的调控作用。这篇文章的通讯作者是中科院北京基因组研究所的杨运桂研究员。 这项研究为人们提供了直接的证据,证明m6A读取器YTHDC1通过招募剪切因子调控mRNA剪切。
目前的m6A分析方法主要是把methyl-RNA免疫沉淀和测序结合起来,称为MeRIP-Seq或者m6A-Seq。这种方法只能将m6A残基定位在100–200 nt的转录本区域中,无法在全转录组水平上鉴定m6A的精确位置。去年六月美国康奈尔大学的研究团队在Nature Methods杂志上发表了一种名为miCLIP的新技术。这种技术可以很方便的获得单核苷酸分辨率m6A图谱。
MicroRNA(miRNA)是一类约22nt大小的内源RNA,在基因表达中起着重要的调控作用,参与了多种生理和病理过程。洛克菲勒大学的研究团队发现,m6A是促进miRNA生成的关键性转录后修饰。这项研究去年三月发表在Nature杂志上,文章的通讯作者是洛克菲勒大学副教授Sohail F. Tavazoie。Sohail F. Tavazoie博士致力于癌症研究,近半年来已经在Nature、Cell杂志上发表了多项重要成果。
-
项目成果
-
焦点事件