单分子测序在肿瘤基因检测中的6大应用
肿瘤是当今导致人类主要死亡的主要疾病之。由于其发病隐匿、治疗方法局限、多数预后不良,且分子生物学特征复杂多变,因而肿瘤的预防、早期筛查与诊断、临床治疗、预后评估一直是临床医生致力于解决的关键问题。随着现代医学技术的发展,肿瘤已经进人了个体化治疗阶段。肿瘤的基因组转录组和表观遗传特征在探究肿瘤的发生、转归和个体化治疗中起到了重要作用。
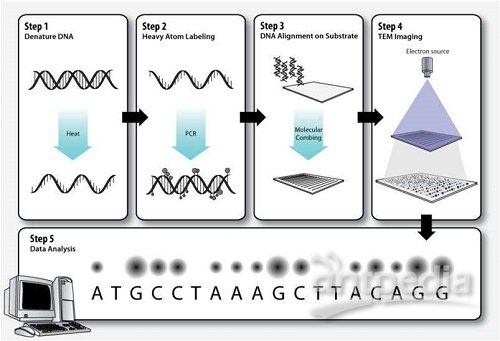
图片来源于网络
在前文中,小编汇总了当前发展的4代基因测序技术并总结了每代技术的优势。在本文中,小编将带您了解第三代测序技术在肿瘤研究中的应用情况。
单分子测序技术种类
目前,单分子测序技术主要包括单分子基因组测序、单分子转录组测序和单分子表观遗传测序,以便从不同角度揭示肿瘤微环境中不同细胞的特性
单分子基因组测序
单分子基因组测序主要包括单分子全基因组测序和单分子全部外显子测序。主要用于鉴定单核苷酸变异、拷贝数变异(copy number variations, CNV)和染色体结构变异。
单分子转录组测序
最常用的方法为单分子全转录组测序,对单分子中mRNA进行基因表达定量、功能富集、代谢通路分析。
单分子表观遗传测序
单分子表观遗传测序主要是研究DNA的表观遗传修饰,如甲基化、羟基化以及组蛋白修饰等。目前最为常用的是单分子甲基化测序( single cell methylation sequencing,scMseq)。scm-seq主要有3种方法:
(1)单分子限制性代表区域甲基化测序( methylation sequencing of single cell restricted representation regions, SCRRBS-seqg);
(2)单分子亚硫酸氢盐测序( single --cell bisulfite sequencing, scBSseq);
(3)单分子全基因组甲基化測序技术( single-cell whole genome bisulfite sequencing, SCWGBS-SEQ)。
其中scBS-seq覆盖的GpG位点最多,约370万个。
多组学测序
同时进行单分子基因组和转录组测序的方法主要有3种:
(1)scGT-seq( single-cell genome and transcriptome codetection and sequencing)采用微流体的方式将两者分离进行測序;
(2)G&T-seqg( genome and transcriptome sequencing):采用物理方法将两者分离测序;
(3)DR-seq(gDNA -MRNA seque)。
单分子测序技术在肿瘤研究中的应用
揭示肿瘤发展过程中单分子基因变异
Kim等从2个肺腺癌患者来源的肿瘤细胞异种植入的小鼠(PDX)中提取了83个细胞进行单分子转录组测序,对其中43个小鼠的重复样本进行全外显子测序,观察到包括 KRASG12D在内的50种肿瘤特异性单核苷酸变异,发现了所有的PDX细胞之间均具有异质性。
Ni等通过对一种肺瘤亚型(不包括其它亚型)的循环肿瘤细胞进行单分子外显子测序,发现个体(甚至不同)患者的CTC中一些高度重现的CNV与耐药相关,一些基因位点(如c-Myc,TERT,HLA)的特定组合的CNV与转移相关,可能的机制是:原发性肿瘤中的癌细胞与某些CNV可以侵入周围组织并有效浸润,这也可能使CTC发生免疫逃逸。
发现肿瘤的异质性
肿瘤的异质性是肿瘤细胞増殖过程中细胞遗传物质在复制、转录和翻译的不同层面发生变化,导致子代细胞在基因型和表型中均存在差异。肿瘤的异质性主要体现在4个层面:不同肿瘤之间、同一肿瘤的不同病灶之间、同一个肿瘤的同一个病灶的不同区域、同一肿瘤的同一病灶的同一区域的不同细胞之间。Kim等用肾切除术后1年内出现独立肺转移灶的透明细胞性肾细胞癌患者的肺转移的肿瘤组织,以及原发的及肺转移的肿瘤细胞异种植入的小鼠的116个细胞进行单分子RNA测序,在单分子水平上发现了肿瘤内部的异质性,发现顽固性患者体内有不同的靶向药物通路活化,制定了靶向转移的癌细胞中的两个相互独立的通路的治疗战略。
Hou等从1例患者的骨髓样本中随机选取了82个骨髓细胞以及8个正常口腔黏膜上皮细胞,进行了单分子全部外显子测序,发现骨髓增殖性肿瘤患者的肿瘤细胞与正常细胞的基因表达谱完全不同肿瘤细胞之间的基因表达也存在差异,呈现遗传多样性。发现不同的细胞同时存在多种基因突变的短暂时期,其中有明显的生长优势的细胞群发展成为肿瘤。
探究肿瘤各亚型之间的基因序列差异
Venteicher等对10例IDH-A肿瘤患者的9879个単细胞和6个IDH-O肿瘤的4347个单分子进行了单分子转录组测序,并将测序结果与165个TCGA的数据对比,发现在IDH-A和IDH-O中观察到有相同的胶质谱系和发育层次结构,表明所有IDH突变胶质瘤起源于同一个祖细胞。与神经胶质谱系的相似性相反,IDH-A和IDH-O在其肿瘤微环境中差异显著,特别是小胶质细胞/巨噬细胞的富集程度。小胶质细胞和巨噬细胞在不同临床分期的IDH-A肿瘤之间也不同。这一研究成果对于此类疾病的管理和治疗具有重要意义。
Casasent等到从10例乳腺导管原位癌和浸润性导管癌患者的肿瘤组织中分离了1293个细胞,并对这些细胞进行了外显子测序,发现了浸润性导管癌与导管原位寤原位癌之间有直接的基因相关性(有相同的突变和CNAs),来自同一个谱系,在发生浸润性改变之前就已经发生浸润性导管癌中的基因突变和复制子变化,一个或多个克隆迁移到周围组织形成了浸润性肿瘤。
区分肿瘤中免疫细胞亚群
heng等从6例肝细胞癌患者的外周血、肿瘤组织、肿瘤邻近部位正常组织中分离了5063个T细胞,进行了单分子转录组测序,对T细胞进行了细胞亚群分类、发展轨迹分析,比较了不同亚群中T细胞克隆的分布,探讨了不同亚群之间的关系,发现了每个亚群的特异性基因表达,发现相较于外周血和癌旁组织的T细胞,肿瘤组织中大量存在CD8T细胞的功能紊乱及抑制性T细胞。并证明 Layili基因对于CD8'T细胞的系伤功能有抑制作用,可能会成为免疫疗法的新靶点。同时,基于TCR数据分析发现,肝瘤内存在大量处于耗竭状态的T细胞,揭示了肿瘤细胞免疫逃逸的原因。此外,该研究还描绘了初始T细胞向耗竭状态的发展轨迹,并在耗竭性CD8T细胞亚群中发现了一类FOXP3抑制性T细胞的存在,提出了耗竭的CD8*T细胞可能会进步发展成抑制性T细胞。
探索肿瘤的发生过程
Tanga等运用最新的 serio-seq技术对1例肝癌患者癌组织中的25个癌细胞同时进行了3种组学的分析。发现这25个肝癌细胞来自2个不同的细胞亚群。在基因组水平上,亚群1中的细胞含有较多拷贝数增加的染色体及染色体片段,而亚群I中含有较多拷贝数减少的染色体和染色体片段;在DNA甲基化水平上,亚群1比亚群1有更高的DNA甲基化水平,且产生的差异大多发生在CpG岛(CGID)区域;在转录组水平上,多个与炎症免疫应答相关的基因,以及与补体激活相关的基因表达在亚群1中都明显降低,而与癌症发生和转移相关的重要基因ANO1和S100A11等的表达在2个亚群中也有明显差别。对于多种组学数据的分析显示,在被检测肝癌细胞中,数量上占比较小的亚群I的细胞的DNA拷贝数变异更多,且DNA甲基化水平更高,可能更易逃脱患者免疫系统的识别,更易出现肿瘤转移。
阐释肿瘤的耐药机制
Miyamoto等从13例雄激素抵抗(AR)的者体内收集77份CTC进行单分子转录组测序。通过将AR患者CTC与未进行治疗患者的CTC进行对比,发现AR组Wnt信号通路激活。从而阐释前列腺癌细胞对雄激素剥夺疗法抵抗的原因。Kim等从2例肺腺癌患者来源的肿瘤细胞异种植入的小鼠(PDX)中提取了83个细胞进行单分子转录组测序,对其中43个小鼠的重复样本进行全外显测序,观察到包括KRASG12D在内的50种肿瘤特异性单核苷酸变异,发现了所有的PDX细胞之间均具有异质性。作者根据KRAS突变和69个肺腺癌预后基因表达的风险评分将PDX细胞分为4组,发现表达 KRASG12D和低风险评分的组的PDX细胞在体外抗癌药物治疗后依旧存活,说明表达KRASG12D和高RS的PDX细胞可能与耐药相关。此外,高表达KRASG12D和高RS的PDX细胞会掩盖无KRASG12D ( KRASWT)和/或低RS细胞类型。具有不同作用机制(细胞毒性和靶向特异性信号转导途径)的杀肿瘤抗癌药物能将高表达 KRASG12D和高RS的细胞转变为低表达KRASG12D和低RS的PDX。从而说明(1)具有激活的KRAS标签的肿瘤细胞是药物靶标,但KRAS突变本身不是靶标;(2)与耐药性相关的肿瘤群体可能被群体内的显性基因组特征的群体掩盖;(3)参与离子通道转运的基因和P型ATP酶的上调可能在耐药性中起关键。
展望
基因突变的积累是导致肿瘤发生发晨的根源,而目前导找癌症突变基因最有效的方式就是基因测序。随着分子生物学的飞速发展,单分子测序技术将逐渐代替NGS技术成为肿瘤基因检测的主流手段。虽然单分子测序技术尚存在一些局限性,但它为研究肿瘤发生发展和转移的分子机制提供了新技术,有望在肿瘤的早期诊断、病程进展和治疗的方面提供新的预防和治疗手段。