全球首个XPO1抑制剂selinexor在美国获批在即
Karyopharm Therapeutics是一家临床阶段的制药公司,专注于发现和开发针对核转运及相关靶标的首创新型疗法,用于治疗癌症及其他重大疾病。近日,该公司宣布,美国食品和药物管理局(FDA)肿瘤药物顾问委员会(ODAC)已计划在2019年2月26日召开会议,对该公司已提交的抗癌药selinexor新药申请(NDA)中的数据进行讨论。此次NDA,申请有条件批准selinexor联合地塞米松用于5重难治性多发性骨髓瘤(MM)患者的治疗。
目前,selinexor正在接受美国FDA的优先审查以及欧盟EMA的加速评估,FDA预计将在2019年4月6日做出最终审查决定。在美国和欧盟,selinexor均被授予了孤儿药资格,在美国还被授予了快速通道资格。
具体而言,selinexor申请的5重难治MM患者是指既往已接受了2种蛋白酶体抑制剂(PIs)Velcade(bortezomib)和Kyprolis(carfilzomib)、2种免疫调节药物(IMiDs)Revlimid(lenalidomide)和Pomalyst(pomalidomide)、1种抗CD38单克隆抗体药物Darzalex(daratumumab),并且其疾病对至少1种PI、至少1种IMiD、Darzalex及最新接受的疗法难治。
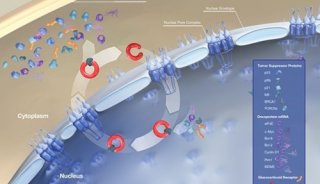
selinexor是一种首创(first-in-class)、口服、选择性核输出抑制剂(Selective Inhibitor of Nuclear Export,SINE)化合物。selinexor通过结合并抑制核输出蛋白XPO1(又名CRM1)发挥作用,导致肿瘤抑制蛋白在细胞核内积累,这将重新启动并放大它们的肿瘤抑制功能,导致癌细胞选择性凋亡,同时不会对正常细胞造成显著影响。
selinexor监管文件的提交是基于IIb期临床研究STORM的数据。该研究是一项国际性、多中心、单组研究,评估了selinexor联合低剂量地塞米松的疗效和安全性。该研究入组了122例既往已过度治疗且对5种不同疗法产生耐药的难治性MM患者。研究中,患者接受selinexor(80mg,口服,每周2次)联合低剂量地塞米松(20mg,每周2次)治疗。
数据显示,selinexor在这类高度难治性MM患者中具有可预测和可管理的耐受性,安全性研究与以往一致。selinexor与低剂量地塞米松治疗的总缓解率为25.4%,中位缓解持续时间为4.4个月。
迄今为止,在临床研究中已有超过2500例患者接受了selinexor的治疗。目前,Karyopharm公司也正在多个中期、晚期临床研究中评估selinexor治疗一系列血液系统恶性肿瘤和实体瘤的潜力,包括多发性骨髓瘤(3个临床研究:BOSTON,STORM,STOMP)、弥漫性大B细胞淋巴瘤(SADAL研究)、脂肪肉瘤(SEAL研究)、子宫内膜癌(SIENDO研究)、胶质母细胞瘤(KING研究)。
-
焦点事件
-
焦点事件

-
产品技术