专家:症状改善不能说是它在起作用 需关注临床药代学
2月6日晚,抗病毒药物瑞德西韦(Remdesivir)临床试验在武汉金银潭医院启动。从媒体关注和社交网络讨论上看,瑞德西韦是一款被人们寄予厚望的药物。甚至临床试验未开始之前,网友们对瑞德西韦药物效果的讨论便层出不穷。
对新冠肺炎疫情新药开发一直保持关注的美国国立卫生研究院博士后研究员、免疫学博士王宇歌接受红星新闻采访时表示,瑞德西韦对新冠病毒究竟有无效果,有待临床试验结果的检验,他更在意患者用药后的咽拭子核酸水平和病死率两个指标。
此前,因为外界对于瑞德西韦的高度关注,网上流传出“24小时内药物就能对患者起效”等传闻。对此,王宇歌表示,症状层面改善不能说明药物在24小时内就起效,药物的起效时间需重点关注临床试验结果中的药代动力学和药效动力学数据。
瑞德西韦进入临床试验
无明显不良反应,有效性待评估
瑞德西韦临床试验项目负责人、中日友好医院副院长曹彬教授在接受新华社采访时介绍,总计拟入组761例患者,采用随机、双盲、安慰剂对照方法展开,首位受药的是一位68岁的男性重症患者。
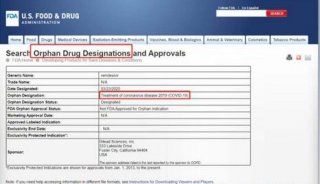
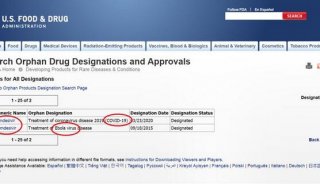
红星新闻以“nCoV”为关键词查阅了[ClinicalTrials.gov](美国临床试验数据库,由美国国家医学图书馆在美国国立卫生研究院运营,目前拥有200余个国家的试验记录)。
截至2月9日,该网站登记了15项与新冠病毒有关的临床试验,而与瑞德西韦这款药物有关的临床试验则有两项,均由曹彬教授负责。它们的分别是“瑞德西韦治疗轻中度2019-nCoV感染的随机临床试验”和“瑞德西韦治疗2019-nCoV重症患者的随机临床试验”,样本量分别是308例和452例,合计760例,比新华社报道的761例少1例。
药效是大众最关心的问题,与此相关的坊间传闻亦数不胜数。2月7日,瑞德西韦的研发公司吉利德科学曾回复红星新闻称,“瑞德西韦(Remdesivir)是一种在研药物,这意味着它作为2019-nCoV治疗手段的安全性和有效性尚未被确定。” “目前我们关注的重点是尽快确定瑞德西韦(Remdesivir)治疗2019-nCoV感染者的潜在安全性和有效性。”
红星新闻梳理近期新闻报道后注意到,截至目前,国内尚无医院和研究机构针对瑞德西韦治疗人感染新冠病毒效果发表过任何结论性信息或言论。
不过,湖北省医疗救治组专家、华中科技大学同济医院呼吸与危重症医学科主任赵建平,于2月7日的湖北省新型冠状病毒感染肺炎疫情防控工作例行新闻发布会上侧面透露过些许线索,他明确指出,“此前瑞德西韦没有明显的不良反应。”
专家:症状改善不能说绝对是它在起作用
通过[ClinicalTrials.gov],红星新闻发现,“瑞德西韦治疗轻中度2019-nCoV感染的随机临床试验”和“瑞德西韦治疗2019-nCoV重症患者的随机临床试验”的实验设计一致,两项临床试验的实验组均为“在第1天给予200毫克口服负荷剂量,然后每天一次100毫克静脉注射维持剂量,持续9天。”
红星新闻还注意到,上述两项临床试验的主要评价标准略有不同,分别为“临床恢复时间”和“临床改善时间”。
“对于新冠病毒感染肺炎这样的急性传染病来说,最重要的是看病毒感染本身——是不是把人体内的病毒数量减少了,即减少了病毒的拷贝数。”美国国立卫生研究院博士后研究员、免疫学博士王宇歌告诉红星新闻记者,虽然现在针对新冠病毒没有绝对全面客观有效,既有灵敏度,又有特异性的检测方法,但是目前正使用的咽拭子核酸检测仍然值得尝试,“看服药以后能不能将病毒的咽拭子核酸降低或者消除。”王宇歌还表示,除了咽拭子核酸水平,病死率也是瑞德西韦药物临床试验值得关注的一个重要指标。
此前坊间传闻,新冠病毒感染者的症状在给药后24小时内得到缓解,说明瑞德西韦在短时间内即以能对患者起效。而《新英格兰医学杂志》上发表的美国治疗第一例输入型新冠病毒感染病例似乎也能支持此说法——病人于隔离治疗第七天开始使用瑞德西韦,第八天症状便开始缓解。
王宇歌表示,药物究竟多久起效,在没有临床实验结果的情况下,谁也无法判断。“病毒感染是有自限性的(即发生发展到一定程度后能自动停止,并逐渐恢复痊愈,并不需特殊治疗,只需对症治疗或不治疗,靠自身免疫就可痊愈),个案感染者用药后症状改善的情况不能说绝对是瑞德西韦在起作用。”对王宇歌来说,他会更关注临床试验结果中瑞德西韦的药代动力学和药效动力学,然后再通过分析核酸降低的水平,最终得到瑞德西韦具体的起效时间。
从实验有效到最终成药,要走多远?
成药可行性与细胞实验中的药物摩尔数相关
2月4日,中国科学院主办的《Nature》旗下期刊《Cell Research》发表了一篇作者为中科院武汉病毒所多位研究员的文章《Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro(瑞德西韦和氯喹能在体外有效抑制新冠病毒)》。
该文章介绍了瑞德西韦和氯喹这两种化合物在体外细胞实验中对新冠病毒的抑制性,也讲述了筛选抑制新冠病毒药物的逻辑。即从过去的研究成果中寻找一些对其他冠状病毒(比如MERS或者SARS)可能有效的化合物,然后在体外做细胞实验。
武汉病毒所筛选药物时候,使用了VERO-E6(一种细胞系的编号)细胞系,它可以被冠状病毒感染。在被冠状病毒感染以后,实验者们再把药加到这个感染的细胞中,观察有多少病毒能被药物抑制。
王宇歌告诉红星新闻记者,目前注意到,现在已经发现不少上市的化合物对冠状病毒有作用。研究者们需要通过药物对病毒的半数有效浓度(一种剂量单位,能产生50%的最大效应的药物浓度,简称EC50),来计算药物的有效率,从而判断药物的活性。
王宇歌说,原则上一个抗病毒药在体外实验中的EC50能够达到纳摩尔(摩尔是一种物质的量单位,约6.02×10²³个原子=1摩尔, 1摩尔=10⁹纳摩尔)级别的,尤其是几十纳摩尔这个级别,那么这个药物就有机会进一步做临床前实验。如果药物的EC50能够降低至个位数纳摩尔水平的话,那么这个药物就可以想办法做成制剂,然后做临床实验。
“细胞实验中的药物摩尔数越低,用在人身上的时候药物总量就越少,就越有成药的可行性。”王宇歌介绍说,2017年,《Science Translational Medicine》发表了一篇用瑞德西韦做老鼠实验的文章,当时给老鼠使用的药物剂量是25毫克/每千克体重,在临床上看这是相对比较大的剂量。此外,该文章显示当时瑞德西韦的EC50只能达到微摩尔级别(微摩尔单位比纳摩尔单位大,1微摩尔=10³纳摩尔),这意味着以当年的实验情况来看,瑞德西韦应用于人体还需要进一步优化。
“不过,当前没有看到实验者的临床实验,尤其是剂量梯度实验数据。所以在没有看到这个证据的情况下,我不好评价瑞德西韦如今最后的成药性如何。”王宇歌说,“这次的瑞德西韦药物实验,第一天给予负荷剂量200毫克口服,以后每天给100毫克的静脉注射,一共给药9天。这样算的话,这个剂量其实比老鼠实验的剂量降低了,所以我们需要关注,以这个降低了的剂量,还能不能有效降低病毒核酸水平。”
药物试验的伦理审查:
如何避免被试者受到伤害或延误治疗
2月5日,针对最近热议的抗病毒“特效药”,钟南山在接受媒体采访时曾表示,临床试验可以加快绿色通道,但必须走程序。“很多实验室找到一个苗头,就希望马上完全进入临床,这个要小心,伦理审查一定要通过。临床医生还是要按临床的规矩来做。”
2月7日,湖北省医疗救治组专家、华中科技大学同济医院呼吸与危重症医学科主任赵建平,透露了针对药物瑞德西韦的随机双盲对照试验部分细节——目前在分组上对重症病人有相应倾斜,“以前分组是1:1,1份治疗用药,1份对照组。这次是2:1,若参加研究有66%的机会用上这个药。”赵建平还表示,对照组患者也不会因为没有用上瑞德西韦延误病情。
伦理审查是一个医学名词,知道其具体概念的普通人不多。但赵建平透露的瑞德西韦药物临床试验设计的部分细节表明,此次药物临床试验为了应对伦理审查的确做出了一些设计上的改变。
王宇歌告诉红星新闻:“以埃博拉病毒感染这种烈性传染病为例。实验者发现了瑞德西韦等药物对埃博拉病毒潜在有效,于是开始设计实验。实验者如果按照常规思路,给入选的埃博拉病人分为安慰剂组(对照组)和药物治疗组(实验组)两组,那安慰剂组里的病人等于没有接受实验药物治疗,他们最后可能就会死掉。这种常规思路的临床试验设计,可能就不能通过临床的伦理审查。”王宇歌介绍说,最后美国和一些非洲国家商量后做了一个决定——药物实验不设阴性对照,全部换成阳性对照,全部设置成实验组,每组接受各种不同的实验药物治疗。
王宇歌说,伦理审查的意义主要是来判断,临床实验是不是在真正帮助了医学研究的同时,也让受试者不会受到任何的身体和心理上的伤害。对于现在急性传染病疫情爆发时的临床试验来说,伦理审查的意义主要是让所有患者都能接受治疗,不要因为临床实验而延误治疗或者进入了对照组从而没有得到治疗支持。
红星新闻记者 赵倩 严雨程
-
焦点事件
-
焦点事件

-
项目成果

-
焦点事件
-
焦点事件

-
焦点事件
-
焦点事件
-
焦点事件
-
焦点事件
-
焦点事件
-
焦点事件
-
焦点事件

-
焦点事件






















