多发性骨髓瘤治疗新曙光:CAR-T细胞疗法
近年来,随着全球精准靶向药物、肿瘤免疫药物的快速兴起,针对各类癌症的临床诊疗进步明显,新药获批层出不穷;而另一方面,全球每年癌症发病率还在不断攀升,加上肿瘤治疗本身极为复杂,临床上仍有较大的治疗需求亟待满足,尤其是针对复发或难治性癌种,后线治疗手段捉襟见肘,比如多发性骨髓瘤(MM)就是一大典型。
多发性骨髓瘤是一种起源于骨髓浆细胞的恶性血液瘤疾病,侵袭性强,几乎无法治愈。据统计,当前全球共有约75万名MM患者,每年新增病例约16万,呈逐年上升之势。虽然针对这一顽疾,全球已有数十款上市品种,多为靶向药物及单抗类药物。即便如此,仍有不少患者无法取得理想的生存获益,尤其对于那些存在特定细胞遗传学异常的MM高危患者而言,由于在复发后缺少有效的后续治疗选择,往往被迫深陷绝境。根据梅奥骨髓瘤分层与风险调适治疗(Mayo Stratification for Myeloma and Risk-Adapted Therapy, mSMART)共识指南中的定义与统计,MM高危患者占到全部患者总数的20-30%,临床未满足需求极为突出。
与此同时,生物医药界针对多发性骨髓瘤发病机理、特异靶点的研究也不断推陈出新,加之细胞疗法在癌症治疗、尤其是恶性血液瘤领域取得的突破性进展,靶向BCMA的CAR-T疗法成为各家药企竞逐攻克多发性骨髓瘤的崭新赛道。这其中,亘喜生物(Gracell Biotechnologies)在近期颇受瞩目,这家刚刚在年初成功登陆纳斯达克的行业明星企业宣布会在即将到来的ASCO年会以及EHA大会期间公布旗下GC012F治疗复发/难治性多发性骨髓瘤最新临床研究进展。
GC012F数据亮眼,复发/难治的多发性骨髓瘤迎来新曙光
亘喜生物即将公布的是旗下GC012F治疗复发/难治性多发性骨髓瘤(r/r MM)的一项多中心、首次人体临床试验中的最新进展,这也是既去年在ASH年会期间首次公布数据后,亘喜对于该项研究的最新披露。
作为管线内的领衔候选产品之一,GC012F是一款基于亘喜生物独有的FasTCARZL平台以及Dual CAR设计打造的BCMA/CD19双靶向自体CAR-T细胞疗法,加上进一步对双CAR单链抗体(scFv)和信号传导通路的优化,有望提升疗效和安全性。据悉,截至今年1月12日,GC012F治疗MM的IIT研究共计入组19例患者,分布于三个治疗剂量组,最高剂量水平为3×105细胞/公斤体重,且患者均符合经过多轮治疗后复发/难治的标准。官方数据显示:早期客观缓解率(ORR)高达94.7%(18/19),所有应答均获得了极佳的部分缓解(VGPR),乃至严格意义上的完全缓解(sCR);从剂量维度来看,不同组别的数据也均呈现出快速、深入、持久的治疗效果。
深入探究还能发现,最高剂量组的数据尤为亮眼,所有患者(n=9)均取得微小残留病灶阴性-严格意义上的完全缓解(MRD -sCR),且在接受GC012F输注后六个月乃至更长时间都保持着深度应答;此外,19例患者中有18例(94.7%)属于mSMART 3.0指南中定义的高危患者;而且,这些入组的患者其中位既往治疗线数为5次,都曾三重暴露于PI、IMiD和至少第三种治疗方案,包括抗CD38靶向疗法。这也预示着对于多发性骨髓瘤患者的中的高危人群,GC012F有望带来不错的临床获益,对于打破当前MM后线治疗的窘境颇具意义。
在安全性方面,GC012F的表现同样良好,与此前观察到的结果一致,主要出现的是低级别的细胞因子释放综合征(CRS),治疗期间发生的不良事件(TEAEs)主要表现为血细胞数减少和AST增加,且所有TEAEs经标准治疗后均得到缓解。
开创性技术平台+基因工程技术,引领下一代细胞疗法
尽管CAR-T细胞疗法潜力巨大,国内外玩家争相入局,但行业整体仍然面临诸如生产时间长、生产质量欠佳、治疗成本高等一系列挑战。但对亘喜而言,公司创始人、董事长兼首席执行官曹卫博士,曾在哈佛医学院和斯坦福大学医学中心从事免疫药理学领域的研究,同时还是80多个国内外细胞治疗技术ZL(申请)的发明人,深厚的技术积累以及丰富的专业经验,加上其核心管理团队均为扎根相关领域多年的“行业老兵”,无疑都是亘喜生物建立差异化优势的“独门秘籍”。开创性的FasTCAR和TruUCAR两大平台,是亘喜在细胞疗法领域引领创新的台柱,支撑其同时在自体与异体CAR-T领域的研发齐头并进——前者旨在开发制备速度更快、细胞质量更高的自体疗法;后者则用于开发便利性更好、成本更优的“通用型”同种异体疗法,再加上能与之形成协同的基因工程技术,亘喜生物的创新引擎正不断驱动其在革新CAR-T行业的道路上稳步前行。
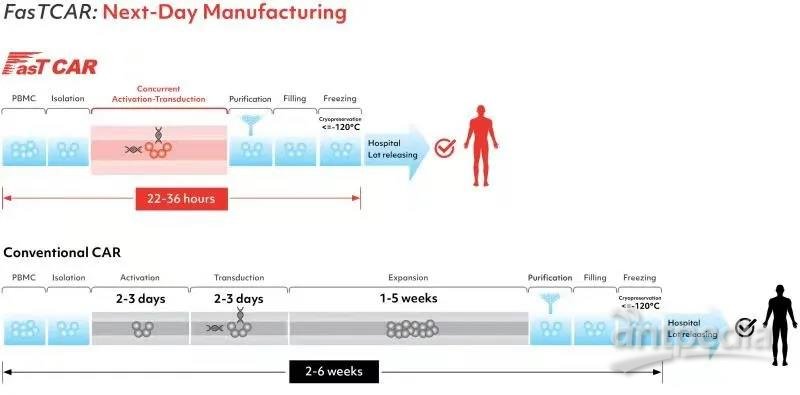
以GC012F的研发为例,打造FasTCAR平台的初衷,就是为了解决传统CAR-T自体疗法普遍存在的问题(生产时间长、制备质量欠佳、治疗成本高、T细胞健康度差等)。有别于传统模式需历经T细胞激活、转染和体外扩增等步骤,不但冗长耗时,且制备质量也不够理想,基于FasTCAR平台开发的自体产品,能同时激活和转导处于静息状态的T细胞,且转导后T细胞具有更好的扩增和肿瘤细胞清除活性,在免去了体外扩增步骤后,次日即可生产完毕,显著缩短了患者等待时间,更自然而然减轻了患者的经济负担。
Dual CAR设计的创新优势,也在GC012F——这款BCMA/CD19双靶向自体CAR-T疗法中初露锋芒。作为与FasTCAR平台相辅相成的一项基因工程技术,顾名思义,在Dual CAR技术加持后,GC012F能通过靶向两处靶点,减少抗原逃逸,并且可以消灭多发性骨髓瘤的前体细胞,以降低患者接受治疗后的复发率;同时,双特异抗原靶向的CAR-T细胞在体内的存活时间也有望比普通单靶向CAR-T细胞更长,意味着更持久的疗效。值得一提的是,Dual CAR还能应用于亘喜另一大通用型异体CAR-T平台:TruUCAR,为减少异体疗法中常出现的宿主抗移植物排斥反应(HvG)反应提供了解决方案。

推动临床进展+完善产能布局,亘喜生物的一盘全球化大棋
亘喜生物成立于2017年5月,正值“CAR-T细胞疗法元年”,FDA在当年批准全球首款CAR-T产品商业化上市。公司发展飞速,逐步在中美两地同步开展运营,持续吸引资本加码,完成3轮融资,并于今年1月8日,也就是在公司成立3.5年即成功登陆纳斯达克,叩开国际资本市场的大门。这不但印证了核心团队在公司运营层面卓有成效,更彰显出这家企业深耕细胞与基因治疗前沿领域,力求向全球输出创新价值的格局与气度。

目前,依托于自主且完整的研发体系,亘喜生物正在打造一条包含多款自体和同种异体候选产品的差异化创新管线,针对性治疗包括多发性骨髓瘤、急性B淋巴细胞白血病、急性T淋巴细胞白血病、非霍奇金B细胞淋巴瘤在内的多个癌种。通过与全球权威临床研究中心与顶级医学专家开展合作,加速驱动更多产品在中国,乃至全球范围内的临床研究,并力求推动更多突破性疗法成为更优先的治疗选择。
因为与传统药物在工艺上存在的天然差异,CAR-T细胞产品的生产制备,始终是贯穿于临床开发至商业化阶段的关键要素,也是部分企业难以突破的瓶颈。对此,曹卫博士有着清晰的认知,并对亘喜在工艺产能上的布局信心十足。他曾表示,亘喜生物在中国已建立起了符合GMP标准的自主生产基地和研发中心,并通过与龙沙集团开展合作,也在美国开始构建具有国际领先水准的cGMP流程,为公司在全球范围内开展各项临床前/临床阶段研究,不断拓展管线确立强大的供应保障。此外,作为公司产业化布局的一项战略利器,全封闭式生产系统也能全面赋能FasTCAR自体候选产品的生产,避免交叉污染、显著降低成本、提高生产率,并形成规模效益,真正做到不断为更多患者开发出高效、经济的创新细胞疗法。
数据显示,全球CAR-T疗法的市场在2020年至2026年内将以34.5%的年复合增长率快速扩容,到2026年年底,预计将达到89.2亿美元。治疗需求日益旺盛,市场潜力也正加速释放,期待这家紧盯临床治疗痛点,坚定探索行业前沿热点的企业,终能成为引领变革的瞩目焦点,不断为全球患者递送生命的“喜”讯。
-
焦点事件