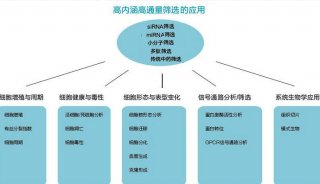
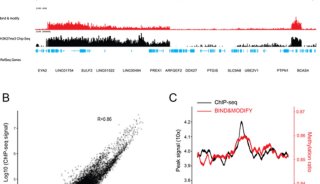
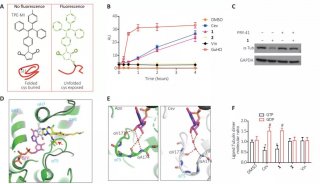
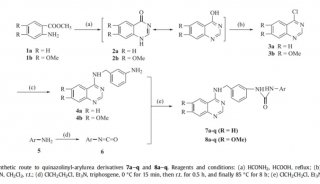
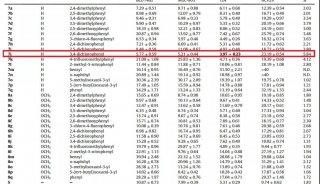
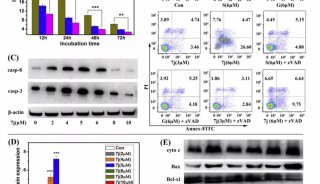
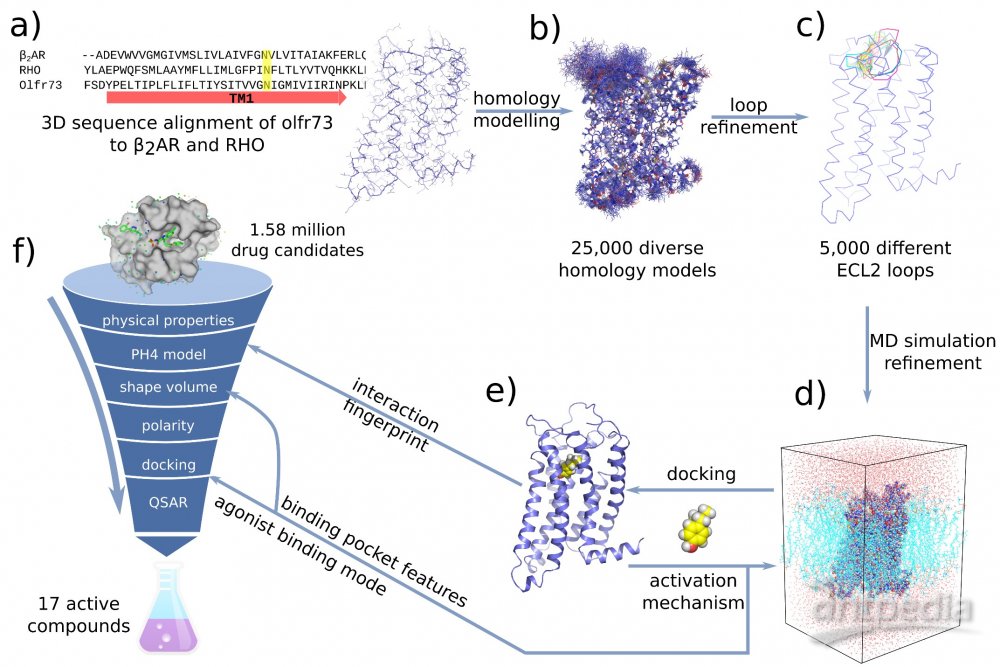
利用人工智能和计算生物学方法 寻找到17个活性药物分子
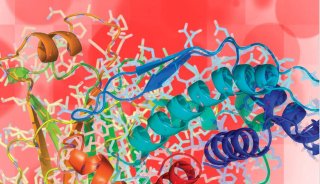
近日,中国科学院深圳先进技术研究院医药所计算机辅助药物设计中心袁曙光课题组带领团队,利用人工智能和计算生物学的方法从158万个化合物中寻找到了17个嗅觉受体蛋白Olf73的活性药物分子。该工作为基于嗅觉受体蛋白的药物发现与设计提供了有力的理论基础和依据。该成果以Computational modeling of the olfactory receptor Olfr73 suggests a molecular basis for low potency of olfactory receptor-activating compounds(《计算机模拟发现嗅觉受体靶向药物结合的特异性》)为题于4月24日在线发表于Communications Biology。第一作者为袁曙光,通讯作者为袁曙光和Horst Vogel。第一单位为深圳先进院。
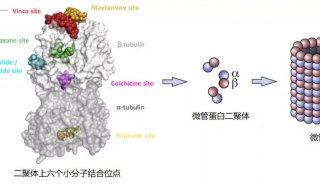
G蛋白偶联受体蛋白(GPCRs)又称七次跨膜螺旋膜蛋白。GPCRs参与着人体的各种生理功能,包括神经信号传递、细胞分化、视觉、嗅觉等。人类的重大疾病如老年痴呆症、癌症、艾滋病也与GPCRs密切相关。GPCRs是最为热门的药物设计和筛选靶标蛋白,目前40%左右的上市药物都是基于GPCRs而设计。因此研究和理解GPCRs的结构与功能,对当今药物设计至关重要。
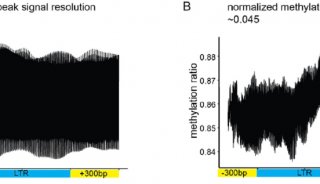
每个蛋白质的特有生理功能与活性,是由它特定的三维结构决定的。因此从蛋白三维结构来理解GPCRs的功能是当今药物设计中必不可少的一个环节。随着结构生物学技术突飞猛进的发展,截至2019年4月底,已经有62个不同种类的GPCRs结构被解析出来。这其中涵盖了GPCRs的A,B,C和F亚家族。然而,嗅觉受体蛋白占据着人源GPCR家族的30%以上,但其结构和功能至今还未很好地被人们所熟知。至今为止,还没有任何的嗅觉受体蛋白的结构被人们解析出来。人工智能和计算生物学在此情况下为人们理解嗅觉受体蛋白结构及其药物分子的功能提供了有力的工具。
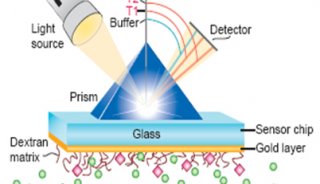
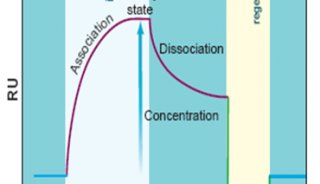
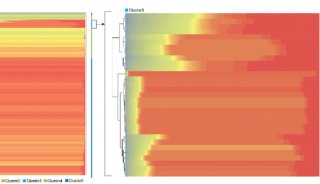
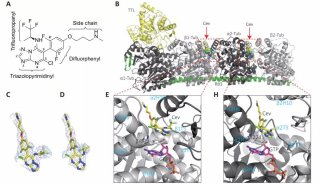
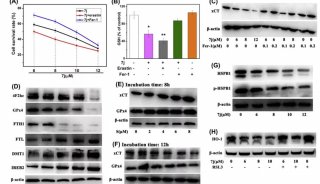
在该工作中,研究人员首先通过计算机模拟的方法构建出嗅觉受体蛋白Olf73的三维结构模型(同源性与晶体结构只有18%)。然后通过分子动力学的方法优化初始模型的三维构象。在通过人工智能和计算机虚拟高通量筛选药物分子的方法预测158万个化合物库中有25个新型分子可能是有活性的。最后生化实验证实,所预测的化合物中17个确实是有活性的,命中率高达68%。
除此之外,研究人员还发现嗅觉受体蛋白的药物分子的分子量比其他GPCR家族要小很多,并且活性要小不少。通过人工智能分析药物分子与靶标蛋白的相互作用指纹图谱发现,嗅觉受体蛋白的药物分子主要以疏水作用为主,而其他GPCR的活性分子则以氢键和盐桥作用为主。功过系统分析GPCR的药物分子结合位点的大小,进一步发现嗅觉受体蛋白的位点比其他GPCR明显要小很多,结合位点区域的电荷也比其他GPCR要少很多。这些因素综合导致了嗅觉受体蛋白的活性分子整体活性比其他GPCR要小不少。
-
焦点事件

-
企业风采
-
科技前沿
-
投融资

-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
-
科技前沿

-
项目成果
-
科技前沿

-
焦点事件

-
焦点事件

-
会议会展
-
焦点事件

-
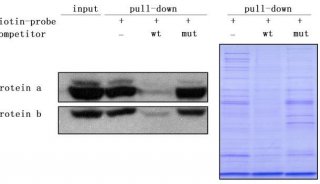
技术原理
-
焦点事件

-
科技前沿
-
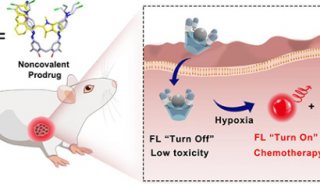
科技前沿
-
精英视角

-
科技前沿
-
科技前沿

-
焦点事件

-
项目成果
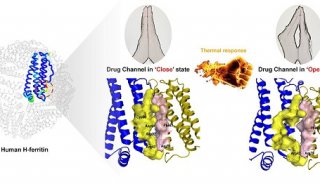
-
企业风采

-
焦点事件

-
项目成果
-
焦点事件
-
焦点事件

-
项目成果