白血病CAR-T细胞疗法!MB-102获FDA批准开展I/II期临床试验
Mustang Bio是一家临床阶段的生物制药公司,专注于开发细胞和基因疗法用于血液学癌症、实体瘤和罕见遗传病的治疗。近日该公司宣布,美国食品和药物管理局(FDA)已批准MB-102(CD123 CAR T)的新药临床试验申请(IND),启动一项多中心I/II期临床试验,评估MB-102治疗急性髓性白血病(AML)、母细胞性浆细胞样树突状细胞肿瘤(BPDCN)、高危骨髓增生异常综合症(MDS)。之前,FDA已授予MB-102治疗AML和BPDCN的孤儿药资格(ODD)。
MB-102(CD123 CAR T)是一种CAR T细胞疗法,对患者T细胞进行工程化以识别和消除表达CD123的肿瘤细胞。CD123广泛表达于骨髓增生异常综合征以及血液恶性肿瘤患者的骨髓细胞,包括急性髓性白血病(AML)、B细胞急性淋巴细胞白血病(B-ALL)、毛细胞白血病(HCL)、BPDCN、慢性髓细胞白血病(CML)和霍奇金淋巴瘤(HL)。
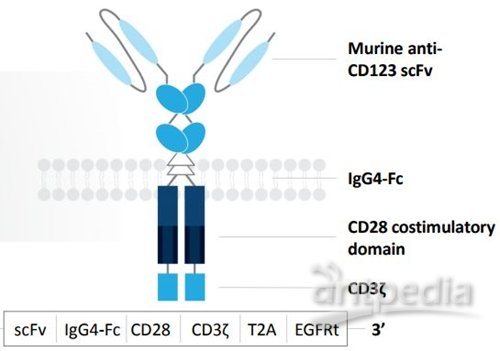
MB-102结构示意图
CD123表达于75-89%的AML、超过90%的BPDCN患者中,因此是T细胞过继免疫治疗的一个非常有吸引力的靶点。在美国希望之城(City of Hope)开展的一项研究者发起的I期临床试验中,MB-102在这些患者的早期小群体中显示出有希望的应答率。
根据美国癌症协会(ACS)的数据,2018年美国估计有19520例新的AML病例,该病的五年生存率估计为25%。在2016年,美国血液学会(ASH)教育项目文章报告称,美国每年约有700例新的BPDCN病例,欧洲每年有1000例,平均生存期为12-14个月。
根据2017年12月美国血液学会(ASH)年会和2018年12月美国癌症研究协会(AACR)肿瘤免疫和免疫治疗特别会议上的报告,在希望之城开展的首个人体临床试验(NCT02159495)中,MB-102以低剂量治疗AML和BPDCN时表现出完全缓解,并且不存在剂量限制性毒性。目前,该研究中2种适应症的剂量递增正在进行中。
Mustang Bio总裁兼首席执行官、医学博士Manuel Litchman表示:“FDA批准了我们对MB-102的IND申请,这是公司实现的一个重要里程碑,因为这是我们的第一个IND。我们很高兴在2019年晚些时候启动我们的多中心I/II期临床试验,并在我们的制造工厂对患者细胞进行处理,该工厂于2018年6月开放。我们热衷于满足AML、BPDCN和MDS患者中的需求,并期待进一步开发MB-102以帮助解决这些毁灭性疾病。”







