多篇重磅研究解读抗生素研究最新进展!
抗生素在对抗细菌感染中发挥着关键作用,已经拯救了数十亿人的生命。本文中,小编整理了抗生素领域最新的重要研究进展,分享给大家。
【1】Nat Microbiol:局部抗生素或能诱发意想不到的抗病毒反应
DOI:10.1038/s41564-018-0138-2
近日,一项刊登在国际杂志Nature Microbiology上题为“Topical application of aminoglycoside antibiotics enhances host resistance to viral infections in a microbiota-independent manner”的研究报告中,来自耶鲁大学等机构的研究人员通过研究调查了细菌对病毒感染所产生的效应,当研究人员在小鼠感染疱疹病毒和其它病毒之前或之后不久对小鼠应用一种常见的局部抗生素后,他们发现,抗生素能够诱发小鼠产生一种特殊的抗病毒耐受性。
来自霍华德休斯医学院的免疫学家Akiko Iwasaki表示,我们重点对一种名为新霉素的抗生素进行研究,这种抗生素能够明显抑制感染小鼠机体中的疱疹病毒活力,并且降低小鼠的感染症状;当研究者对抗生素治疗后的小鼠机体中的基因表达进行研究后,他们发现,小鼠机体中由干扰素所刺激的基因表达明显增强了,干扰素是一类能阻断病毒复制的蛋白质类;通过后期深入研究,研究人员表示,新霉素能够诱发小鼠机体免疫细胞表面的受体对抗生素产生反应,这就类似病毒感染一样。此外,研究者还证实了新霉素在感染流感病毒和寨卡病毒的小鼠机体中的确存在一些抗病毒的效应。
这项研究非常重要,后期研究人员希望通过进行更为深入的研究,利用一些局部使用的抗生素来治疗人们的病毒性感染;此外,本文研究结果还能加强研究人员理解抗生素对机体所产生的抗病毒效应,同时还能帮助研究人员开发出更好的抗病毒疗法。
【2】Mol Cell:新型抗生素可有效治疗药物耐受性
DOI: 10.1016/j.molcel.2018.03.001

最近,来自芝加哥伊利诺伊斯大学的研究者们以及与来自法国的生物科技公司Nosopharm合作发现了一类新型的抗生素。这类新型的抗生素是由Nosopharm首先发现的,它具有两方面的新颖性与独特性:首先,它的来源十分独特,其次,它杀伤细菌的方式也十分特别。这些特征预示该类化合物具有治疗多种耐药性细菌的作用。
为了鉴定这一抗生素,来自Nosopharm的研究者们筛选了80株不同的菌株,并且比较了它们的抗菌能力,之后分离得到了上述活性物质,并且研究了其化学结构,从而设计得到了更为有效的衍生物。这项研究结果发表在最近一期的《Molecular Cell》杂志上,该文章首次揭示了上述化合物的工作机制。作者们发现,ODL能够与细菌内部负责合成蛋白质的关键元件—核糖体相互结合。
与以往的抗生素不同,虽然ODL能够靶向核糖体发挥作用,但它们与核糖体结合的部位是并不出现在此前的抗生素中”,作者们说道。此外,作者还发现当ODL与核糖体结合之后能够破坏mRNA的翻译以及蛋白质的合成过程。
【3】Nature:发现一类杀死超级细菌的新型药物---类维生素A抗生素
DOI:10.1038/nature26157

在一项新的研究中,来自美国布朗大学、哈佛医学院、埃默里大学和西北大学的研究人员发现一类能够杀死小鼠中的耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA)的新型抗生素。这类被称为合成类维生素A抗生素(synthetic retinoid antibiotics)的药物与维生素A属于同一个化合物家族。他们对类维生素A进行化学修饰,使得它们依然能够攻击MRSA,同时将它们的毒性降至最低。相关研究结果于2018年3月28日在线发表在Nature期刊上,论文标题为“A new class of synthetic retinoid antibiotics effective against bacterial persisters”。
在即将出现的抗生素耐药性危机和多重耐药的“超级细菌”进化的过程中,寻找可用于抵抗它们的新型化合物的任务变得越来越迫切。根据2010年的一项研究,科学家们已鉴定出4000多种天然的和合成的类维生素A。Wuest和他的同事们利用一种检测方法测试了82000种合成化合物,从中发现两种分子---CD437和CD1530---通过破坏MRSA的细胞膜中的脂双层来杀死它们。重要的是,这两种化合物不仅能够杀死正在生长中的细胞,而且还能够杀死所谓的“持留菌(persister)”细胞。持留菌细胞指的是变得不活跃并且经常对抗生素产生耐药性的细菌细胞。
论文通信作者、布朗大学分子微生物学家Eleftherios Mylonakis说,“我们对这些化合物发挥功能的方式感到非常乐观。”他补充道,通过对细菌细胞膜进行攻击,这些药物攻击“细菌中非常容易通过药物加以靶向的部分”。这些研究人员还将CD437与常用的抗生素庆大霉素联合使用,从而地成功治疗感染上MRSA的小鼠。即使经过100天的治疗,这种细菌也不会对这些药物产生耐药性。
【4】JMC:合成抗生素治疗耐药性细菌感染展现潜力
DOI: 10.1021/acs.jmedchem.7b01634

根据最近一项研究,一种新型的人工抗生素能够成功地抵抗超级细菌的感染,这是三十年来在抗生素领域的最重要的突破之一。这项突破对于开发新型的泰斯巴汀(teixobactin,一种2015年被美国科学家们发现于土壤样本中的新型抗生素,可以用于治疗耐药性金黄色葡球菌以及耐药性场球菌)类似药物也具有重要的意义。
通过将抗生素结构的关键部位的氨基酸进行置换,研究者们使得泰巴斯汀的制备工艺变得更加简单,此外,这种简化版本的泰巴斯汀同样具有极强的体外杀伤耐药性细菌的能力。之后,来自新加坡眼科研究所的研究者们检测了该化合物对小鼠感染的治疗效果。
结果显示,这种药物不仅能够消除感染,而且能够将感染负面症状降到最低,这一效果远远优于临床上常用的抗生素莫西沙星。相关结果发表在最近一期的《Journal of Medicinal Chemistry》杂志上。
【5】Cell:从结构上揭示转座子扩散抗生素耐药性机制
DOI:10.1016/j.cell.2018.02.032
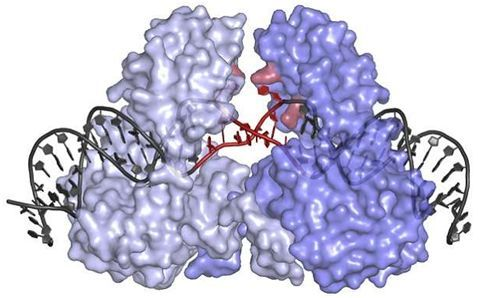
在一项新的研究中,来自位于德国海德堡市的欧洲分子生物学实验室(EMBL)的Orsolya Barabas及其团队着重关注转座子及其分子结构。他们首次解析出一种转座酶-DNA复合物的晶体结构。作为一种转座子插入机器,这种复合物将转座子(包括它们携带的耐药性基因)插入到受体菌中。
Barabas团队发现作为转座子插入机器的主力,转座酶具有不同寻常的形状。这使得它在无活性状态下结合到转座子DNA上,从而阻止这种转座子遭受切割和破坏,直到它能够将抗生素耐药性基因导入到新的宿主基因组中。这种转座酶的特殊形状也迫使转座子DNA解螺旋和开放,从而允许这种转座子将它携带的抗生素耐药性基因插入到极其多样化的细菌基因组中的很多位点上。
基于这种晶体结构,Barabas和她的同事们还开发出分子,并提出了阻止转座子移动的原理论证。她说,“从长远来看,这可能有助于控制抗生素耐药性基因的扩散。”他们提供了两种策略来阻断抗生素耐药性基因转移。第一种方法是通过用新设计的肽分子阻断这种转座酶蛋白的结构,从而阻止它进入它的活化构象。第二种方法是构建DNA模拟物(DNA-mimic),它结合到这种转座子内的开放位点上,因而阻断抗生素耐药性基因转移所需的DNA链替换。
【6】Cell:突破!科学家有望开发出杀灭耐药细菌的新型抗生素!
DOI: 10.1016/j.cell.2017.12.009

在将近40年的时间里科学家们并没有发现或开发出新型的抗生素,当然了研究人员从自然界中发现了许多天然物质,但从开始寻找到最后测试新型物质的特性等整个过程往往是非常缓慢且费力的。现代医学对这些化合物的需求非常迫切;据世界卫生组织数据显示,抗生素的使用至少延长了人类20年寿命,但这种保护作用如今似乎随着细菌慢慢进化出抗生素耐药性而变得越来越弱了。
这项研究中,研究人员对大约80万种名为肽类的分子进行筛选来观察是否这些肽类具有抗菌效应,即是否能够杀灭有害细菌,当然了研究人员发现了多种能够杀灭大肠杆菌的分子,也就是说,这些分子有望被开发成为新型抗生素。目前使用的一些抗生素就是肽类物质,随后研究人员就需要确定是否这些新发现的肽类分子能够安全有效地在人类机体中发挥作用,其中研究人员发现了一种名为P7的肽类分子还能够杀灭其它类型的致病菌,同时在小鼠机体中能够安全使用。
在名为表面局部抗菌展示技术(SLAY,Surface Localized Antimicrobial Display)的应用下,研究人员就能够更加快速且有效地筛选出多种有效的化合物分子,他们希望看到这种方法能够成为帮助全球研究者寻找新型抗生素的标准工具。研究者Davies说道,这项研究的关键之处就在于其能够让细菌产生对自身具有毒性的分子,同时还能控制这些分子与宿主机体细菌之间的相互作用。那么如果细菌能够合成出这种特殊化合物是否就太好了呢?因为细菌非常廉价,而且非常容易生长。
【7】Nat Commun:科学家对古老抗生素进行修饰 有望开发出新型抗菌药物
DOI:10.1038/s41467-017-02118-7

D-环丝氨酸是一种古老的抗生素,其能有效治疗诸如结核病等多种致病菌感染,但通常是作为二线治疗药物,因为其会产生一定的副作用。如今研究者发现,D-环丝氨酸能够以多种不同的方式对多个细菌靶点发挥作用,该药物能通过抑制细菌细胞中两种不同的酶类来发挥作用,这两种酶类分别为D-丙氨酸外消旋酶和D-丙氨酸—D-丙氨酸连接酶,每一种酶类都能帮助构建并维持细胞壁结构的完整性。
这项研究中,研究人员首次揭示了D-环丝氨酸如何抑制D-丙氨酸—D-丙氨酸连接酶的功能,研究者Luiz Pedro Carvalho博士说道,我们发现,D-环丝氨酸能够与D-丙氨酸—D-丙氨酸连接酶结合,并对该酶进行化学性修饰;如今我们完全理解了抗生素药物如何拥有不同的方法来对完全分离的靶点进行作用,这或许是抗生素大家族中独一无二的。
此外,本文研究还阐述了一个事实,那就是,我们对抗生素的了解远比我们想象的要少得多,尤其是在抗生素的作用机制及细菌如何对抗生素产生耐药性上。通过理解抗生素所诱发的分子和细胞事件,我们或许就能够对当前药物进行修饰,来应对当前我们所面对的日益严重的抗生素耐药性问题了。
【8】Cell Host & Micro:突破性发现!抗生素还会帮倒忙 降低免疫细胞杀灭细菌的能力
DOI: 10.1016/j.chom.2017.10.020
正常情况下,抗生素能同机体免疫系统协同作用来消灭感染,然而有些药物常常会有广泛的副作用,比如在抵御病原体的同时也会杀灭机体中的有益细菌,近日,一项刊登在国际杂志Cell Host & Microbe上的研究报告中,来自哈佛大学等机构的研究人员通过对小鼠研究发现,抗生素还能降低小鼠机体免疫细胞杀灭细菌的能力,并且改变疗法所产生的机体环境从而有效保护病原体。
此前研究人员通过研究发现,多种类型的抗生素或会损伤小鼠和人类上皮细胞中的线粒体,而且对药物敏感的细菌也会被小分子代谢产物所影响,这些代谢产物就是细菌在代谢反应过程中所释放的。研究者Yang及同事推测,未来抗生素疗法或会以影响细菌和免疫细胞的方式来改变机体的感染微环境,为了对此进行调查,我们利用常用的抗生素—环丙沙星对感染大肠杆菌的小鼠进行治疗,随后观察小鼠治疗后的表现。
结果研究者发现,抗生素疗法能够诱发小鼠机体中代谢产物的系统性改变,而这并不是通过影响小鼠机体的微生物组,而是通过直接作用于小鼠机体的组织而引发的,深入调查后研究者发现,小鼠机体细胞所释放的代谢产物能够促进大肠杆菌对环丙沙星更加耐受,而且抗生素的暴露也会通过抑制小鼠机体免疫细胞的呼吸活力来损伤免疫功能,环丙沙星处理后的巨噬细胞或许就不再能够有效吞噬并杀灭大肠杆菌了。
【9】Scientific Reports:分娩时使用抗生素会破坏新生儿肠道共生菌群
资讯出处:Antibiotics administered during labor delay healthy gut bacteria in babies

根据最近由曼彻斯特大学研究者们做出的一项成果,在女性分娩的时候使用抗B型链球菌(BGS)抗生素治疗会导致婴儿肠道微生物菌群的发育受阻。这项研究表明,使用抗GBS抗生素对早期时候婴儿体内的肠道菌群发育存在严重的影响,而且随着使用抗生素时间的增加,这一效应更加明显。
虽然抗生素对婴儿肠道微生物的早期发育存在影响,但这一效应在12周之后变得不再明显,相关结果发表在最近一期的《Scientific Reports》杂志上。“早期时候的肠道菌群定植对于机体的健康发育以及免疫以及代谢等过程的正常进行具有重要的意义”,该研究的第一作者,来自曼彻斯特大学医学院的助理教授Jennifer Stearns说道。
由于四分之三的孕妇都在例行检查中发现存在B型链球菌感染,因此往往在分娩的时候会接受抗生素辅助治疗,否则婴儿感染B型链球菌会导致严重的脑膜炎甚至死亡的发生。这种做法已经成为了重要的预防婴儿感染的手段。在这项研究中,作者比较了74对母子的相关数据,分四次检测了婴儿在出生到12周的时间段内肠道菌群的发育情况。这些婴儿大多都是通过顺产的方式出生,少部分通过剖腹产的方式出生。与此前研究相符,剖腹产的婴儿的肠道菌群定植速率要相对低于顺产的婴儿。
【10】Cell Rep:使用抗生素会提高小鼠患病毒感染的风险
DOI: https://doi.org/10.1016/j.celrep.2018.03.001

最近,来自华盛顿大学圣路易斯分校医学院的研究者们发现小鼠在受到抗生素处理使得肠道微生物结构紊乱之后,会提高其感染西尼罗病毒后的症状严重程度。相关结果发表在最近一期的《Cell Reports》杂志上。
在这项研究中,作者首先给小鼠进行了抗生素处理(万古霉素、新霉素、青霉素、甲硝唑),持续两周的时间,之后进行了西尼罗病毒感染。结果显示,接受抗生素处理的小鼠中仅有20%能够在感染后存活,而相比之下对照组小鼠的存活率则有80%。后续的研究结果表明小鼠在接受抗生素处理之后一周内都处于高风险的阶段,而抗生素处理三天就能够足以导致小鼠死于细腻罗病毒感染。
通过检测小鼠体内的免疫细胞,作者发现抗生素处理会降低体内CD8毒性T细胞的数量,而上述细胞对于抗病毒反应具有重要的作用。该研究目前是以小鼠为对象进行的,因此还需要更多的后续研究证明人体的肠道微生物也影响了机体抵抗西尼罗河病毒感染的能力。