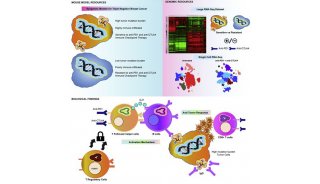
Nat Cell Biol.:科学家解开乳腺癌细胞转移之谜
乳腺癌细胞迁移问题一直以来是一个迷。而就在最近科学家可能已经解决了是什么在癌细胞潜伏了数年甚至数十年之后激活了它们这个问题。癌细胞周围的微血管形成了癌细胞壁龛,是癌细胞存活的微环境。伯克利国家重点实验室的科学家发现微血管的变化控制了癌细胞的休眠状态。当血管开始生长的时候,新生成的血管头部释放的分子能够将癌细胞从休眠状态变为可迁移状态。
在少数乳腺癌病人中,癌细胞能够顺着血流从乳腺组织转移到身体其他组织,进入休眠状态,而该癌细胞在临床上很难被检测到,经历过一段时间后,该休眠癌细胞会具有转移性。一旦转移发生就无法治疗。
该文章的通讯作者Mina Bissell博士称,我们的研究显示了稳定的微血管会形成癌细胞休眠壁龛,而微血管生长会促使癌细胞生长。微血管生长通常是由于组织生长,而一旦癌细胞恰好在错误的时间出现在错误的地点,癌细胞就会受到血管头部因子影响,开始扩增。
Bissell博士之前的研究发现围绕着乳腺周围的基底膜提供了正常表皮细胞生长的微环境。乳腺癌细胞通过循环系统进入到其他器官中,而通常是肺脏,脊髓,脑和肝脏。而该过程中乳腺癌细胞首先要穿过基底膜微血管。于是科学家推测基底膜可能是乳腺腺癌细胞在其他器官处于潜伏状态的原因。
科学家采用两种人乳腺癌小鼠模型来检测他们的假说,科学家在小鼠肺脏,脊髓和脑组织中找到了休眠的乳腺癌细胞。为了检验血管内层的内皮细胞是否能够直接影响乳腺癌细胞生长,科研人员创建了肺脏和脊髓微血管环境模型,在这个模型中,内皮细胞形成血管样结构,将癌细胞放置于血管样结构之上,观察其变化。
采用该模型,Bissell博士领导科学家们发现在稳定微血管中大量表达的蛋白thrombospondin-1能够抑制乳腺癌细胞生长,形成了休眠微环境。而当血管细胞开始生长的时候,thrombospondin-1蛋白给TGF-beta 1 和 periostin蛋白让路,于是微环境变成了转移微环境,促进癌细胞生长。
Ghajar博士称,我们首次在细胞层面和分子层面上定义了休眠壁龛,而且我们发现稳态是关键。破坏了血管内皮会破坏休眠壁龛,从而会造成乳腺癌细胞增殖。
Ghajar博士称,我们的发现揭示了一个控制癌细胞转移的治疗方法。休眠的癌细胞就像定时炸弹,但是我们现在知道了导火索,有望开发出一种治疗手段能够保持癌细胞一直处于休眠状态,或者在其爆发之前消灭该休眠癌细胞。
Ghajar博士和Bissell博士正在研究该乳腺癌机制是否同样适用于其他的转移性癌症。
-
项目成果
-
项目成果
-
焦点事件