制药领域中的微生物风险监控
所谓的注射药物的无菌消毒有着非常严格的产品技术规范。例如,GMP药品生产质量管理规范就规定了专门的无菌测试方法,此法中,滤膜就是一个关键性的元器件。
如今的生物技术领域中,微生物和真核细胞作为特定的供试菌株、药品成分有着越来越重要的意义了。设想一下,1928年,若不是Alexander Flemming医生偶然从细菌产生的黄青霉中发现了青霉素,我们难以想象今天会是怎样的世界。目前,全球药品生产领域以每年大约9620亿美元(2012年数据)的销售额而跃居为当今举足轻重的工业领域。此领域提供的医药产品是人们日常生活中的必需品,并像其他工业产品一样分为常规药品和有规定的特殊药品。但由于药品的使用对象是人类或动物,它们被列为“特殊类型物资”,有着特殊的待遇。

图1.Sterisart NF无菌检测系统的万能泵包括了显示屏和条码扫描仪,它可在无菌测试中输送所需的介质。
GMP管理规范监管下的药品生产
日常使用的眼药水很易受到铜绿假单胞菌的污染,比如,1968年在瑞典发生的眼药水污染事件,使用了受污染的眼药水后人们的视力明显降低,严重时会导致失明。如果病原体(细菌、病毒、真菌、寄生虫)成功进入血液并不断繁殖,则被称为败血症,这是病原体或其毒素对人体免疫系统报复。因此在药品生产质量管理规范GMP中规定了药品生产企业的义务,质量保证和质量管理部门采取一定的措施来保证药品的安全可靠性。
GMP的内容不仅涉及到药品本身,也涉及到药品的生产、包装和药品检验以及供货中所有的原材料,包括了机床设备和仪器仪表。GMP规范的核心是人:人的卫生、人的素质。药品生产过程中最重要的就是要把微生物的污染降低到最低程度,最终产品药微生物污染的在线监控和杀菌是最佳的,也是药品生产最基本的组成部分。
Sartorius Stedim生物技术公司就是这样一个为制药企业提供专业产品和技术服务的企业,他们认为产品的质量和安全可靠性和是药品生产的重中之重。而药品生产的质量监控也为药品生产企业提供了可靠的解决方案。该公司提供的药品生产质量监控产品包括了从分析天平开始到纯净水制造系统、吸液管和耗材,还包括领域中的创新产品。比如,Microsart@filter滤器、Mycoplasmen检测试剂盒和空气采样器。在注射药物最终产品的无菌测试中也有像Sterisart NF这样的产品。

图2.集成式的条码扫描仪方便了Sterisart NF无菌检测系统原始包装条码的扫描和记录。
注射药物正确的无菌测试
对注射、输液或者移植到人、动物体内的药品的无菌测试有着非常高的要求。无菌检验是关系到整批次产品是否合格的决定性评判标准。最终产品的无菌检测既可由生产厂家来完成,也可由具有认证资质的独立第三方来完成。根据国际药典(USP<71>,EP 2.6.1,JP 4.06, WHO QAS/11.413 final),无菌检测不仅适用于注射药物,也适用于眼药水、软膏、护肤霜、喷雾药剂和固体形式的外科缝合材料。无菌测试样本中微生物的培育方法早在1930年就已经出现了。需要检测的药用产品不是按照USP<71>或者EP 2.6.1进行过滤,采用的首选方法是在没有其他可能性的情况下直接‘接种’微生物。
无菌测试是在受控的无菌环境中进行的,既可在具有洁净室等级A级的隔离室中进行,也可在洁净室等级A级的实验室中洁净室等级B级的环境中进行。应规定好无菌测试过程中关键区域,避免交叉污染,保证微生物不会影响无菌测试过程。
在环境条件的监控中要选择一些合适的方法,例如利用MD8 Airscan台式浮游菌采样仪在不干扰洁净室保护区的情况下主动采集空气样本。在要求特别严格的区域内,例如在灌装、隔离室或在吹瓶-灌装-密封系统的区域内,用户对GMF明胶滤膜很高的病毒、微生物滤除和回收率很有信心。无菌测试对系统、材料以及执行无菌检测人员的要求也很高,训练有素的实验员很有必要。
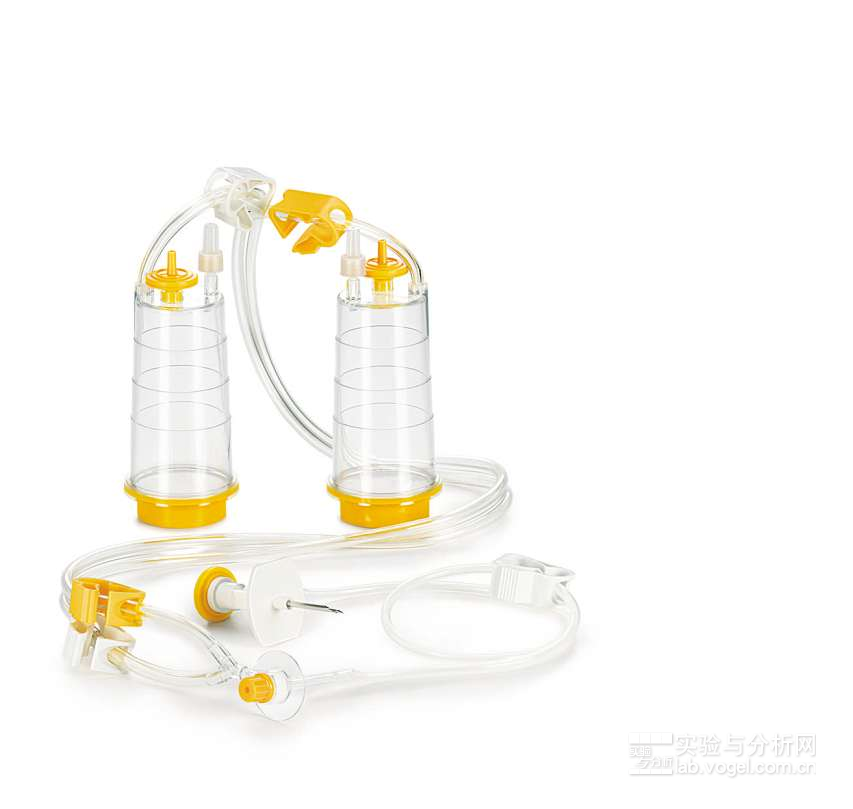
图3.例如Sterisart NF无菌检测系统的Septum变型也可以用于无菌测试。图示的变型就是一种短双针、可自动无菌通风的安全平台式的变型。
无菌测试应注意些什么?
首先要弄清楚医药产品销售国的有关规定,这是进行无菌测试的前提条件。例如:几乎在所有国家里无菌测试都是在两种介质、两个培养皿组成的系统中进行的。但在中国则必须使用三皿的变型系统进行无菌测试的菌株培育。
早在1975年时,席勒系统在德国非常著名,甚至在欧洲也得以普及。但它却因为组装耗时多、易出现假阳性结果等不被美国、日本等国接受。
对于无菌测试的步骤有明确规定:需要有符合洁净室质量标准的压缩空气源,例如,蠕动泵负责将膜滤后的分析液输送到无菌检测单元中去。经膜滤设备(标准过滤精度0.45µm)过滤后,病菌都被截留在系统外;抗生素和其他生长抑制剂成分也可以轻松地被清除掉。若被测药品为粉末,则应先溶解后检测,然后密封好两个培育皿,添加合适的营养液,检测好氧菌时加入CASO,检测厌氧菌时添加流体硫乙醇酸盐培养基。允许使用的冲洗器可以在USP<71>中查阅。一般情况下冲洗器或盛放产品的隔膜需要多次被刺穿,要注意针头足够锋利。
为使无菌测试过程符合GMP管理规范要求,测试过程中所使用的所有元器件,包括无菌测试系统,都要有批量可追朔性;最好是每一件包装的条码都可以扫描识读,把数据按照‘联邦法规’(21 CFR Part 11)的规定保存为PDF格式的文件。
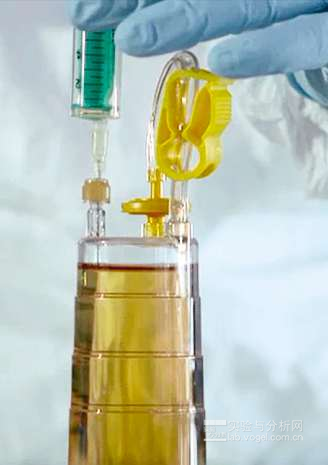
图4.Sterisart NF无菌检测系统的Septum变型可以完成从培育容器中无菌取样的操作,绝无交叉污染的风险。
无菌制剂的安全可靠性
在检测指定的无菌制剂时,Sartorius公司研发了最终检验用的Sterisart NF 一次性检测系统,它是封闭的、一次性使用的系统,可完成袋、注射器、瓶、安瓿和粉末的无菌检测,其基本原理是膜过滤技术。研发、Sterisart NF系统的目标是:实现可重复再现的可靠结果,避免出现假阳性和假阴性检测结果。
经过14天的交叉污染培育或产品变型后,可将无菌样本从培养皿取出或加入营养液(如青霉素酶抑制抗生素)。如今,提取大多数都是通过穿刺针刺穿软管、然后用滴液管加入溶液来完成的。这样,不仅交叉污染的风险提高了,且实验员被针头误伤的几率也变高了。利用Septum版的Sterisart NF无菌检测系统可明显降低提取过程中的风险,方便提取操作。
Septum技术在医药领域得到了广泛的认可,并成功被推广应用。Septum系统可以用封口帽密封起来,必要时可用沾有异丙醇的湿巾擦拭。USP<71>建议:“...开始培育14天后,将一定份额(不少于1ml的介质)注入有营养液的新容器中...。”这里的液体提取转移过程可用Septum版的无菌检测系统可靠、安全的完成。液体转移可利用申请ZL保护的双针来实现。这种不锈钢材料制成的双针非常锋利,在穿刺Septum系统时非常省力;另一方面,与传统的单针相比较它的使用操作也非常方便,因为它无需使用单独的通风过滤器。
Sterisart NF无菌检测系统的万能泵可以有效的帮助完成被测产品向无菌检测系统中的液体转移过程中。系统中集成的条码扫描仪可使用户轻松完成所有无缝连接的可追朔记录。例如完成所有介质、Sterisart NF无菌检测系统的连接。这种万能泵的一个重要特点就是:它是按照洁净室使用条件设计的。泵表面使用的是316L号不锈钢材料,可在纯净工作台上使用,也可集成在隔离室中使用。除了H2O2兼容性之外,它的每个零部件都有很好的抗紫外线照射消毒和耐高压消毒的能力。这对于超净工作台上来说是很有必要的。这一满足GMP药品生产质量管理规范要求的Sterisart NF万能泵是全封闭的,一条通风换气的缝隙都没有。
无菌测试
无菌测试既可在(B级洁净室内的)A级洁净室也可在满足A级洁净室等级规定的隔离室中进行。如今,大多数测试都是在隔离室中完成的。其优点是:隔离室中完成的测试结果具有可靠性,而且相比在超净工作台完成的产品,无菌制剂通过认证的可能性较大。当然,可靠的无菌测试也要求实验人员具有高素质。







