Inscopix在研究焦虑细胞的受体靶点的应用(一)
写在开头:
2020,相信大家也和小编一样,在家宅了很久很久,长时间的隔离在家不出门,网络上铺天盖地的疫情信息,让不少人感到了迷茫、紧张、不安,甚至有了那么一丝丝恐慌,这些大都是正常的应激反应。如果感觉自己受到了过多的负面消息的影响,请将注意力适当的抽回来,专注与自己的生活和感受,避免被负面情绪压垮,出现心理应激表现。
在此,我们也为大家解读一篇最新发表在“Neuron”上的研究论文,去了解一下大麻激活的大脑受体与焦虑和压力之间的联系,从分子水平的药理学治疗,调节与压力相关的焦虑和抑郁症状。
摘要
杏仁核和背内侧前额叶皮层(dmPFC)之间的功能耦合与消极情感状态的产生有关;然而,压力增加杏仁核- dmPFC突触强度并产生焦虑样行为的机制尚不清楚。范德比尔特大学医学中心(Vanderbilt University Medical Center)的研究人员结合Inscopix在体超微显微成像技术和动物行为学实验相结合,发现大麻激活的大脑受体可以作为减少压力的靶点,激活受体的分子可以较少两个脑域之间的焦虑关联,进而保护个体免受压力侵害。这项研究近期发表在Neuron上,“Endocannabinoid Signaling Collapse Mediates Stress-Induced Amygdalo-Cortical Strengthening”。
研究人员证明了小鼠基底外侧杏仁核(BLA)-边缘前前额叶皮层(plPFC)回路是通过应激和激活这一途径在抗焦虑中发挥作用的。此外,他们还证明了急性压力暴露会导致在相互的BLA-plPFC-BLA亚回路中突触强度的持续增加。重要的是,发现2-花生四烯酸甘油酯(2-AG)介导的内源性大麻素信号是限制BLA-plPFC突触谷氨酸释放的关键机制,而多模态2-AG信号的功能崩溃则是导致应激暴露后持续的电路特异性突触强化和焦虑样行为的分子机制。这些数据表明,2-AG信号通路的电路特异性损伤可能促进BLA和plPFC之间的功能耦合,以及环境应激向情感性病理的转化。
正文
压力暴露是导致严重抑郁、焦虑和物质使用障碍等精神疾病发展和恶化的主要危险因素。此外,严重的压力会最终发展为创伤后应激障碍(PTSD)。在此背景下,了解压力暴露转化为独特的病理行为、情绪和认知领域的分子、细胞和环路水平的机制可能具有广泛的临床意义。此外,阐明压力与情感性精神病理之间的分子机制可以揭示减轻压力对精神健康不良影响的新治疗方法。尽管许多压力调节神经调控信号系统的识别已经揭示了情感性疾病潜在的新的治疗靶点,内源性大麻素(eCB)信号系统是一个主要的药物开发候选代表。
eCB信号系统与应激反应生理学密切相关,而eCB信号的药理增强被认为是一种治疗应激和创伤相关精神疾病的新方法。在突触水平,2-花生四烯基甘油(2-AG)介导的eCB信号是一个广泛表达的抑制性逆行信号系统。具体地说,2-AG是由突触后神经元通过二酰甘油-脂肪酶(DAGLa)以活动依赖的方式产生,并激活突触前CB1受体,降低神经递质释放的概率。2-AG被单酰甘油脂肪酶(MAGL)在突触前末端和胶质细胞中表达降解。最近的研究表明2-AG信号是一种关键的应激调节系统,2-AG增强是一种治疗应激相关精神疾病的新方法。例如,2-AG的缺乏与焦虑增加、恐惧消退受损以及对应激性焦虑的易感性增加有关。相反地,2-AG的增加可以提高压力恢复力,防止压力引起的焦虑。尽管有这些数据,2-AG与环境压力相互作用从而影响情绪行为的精确的细胞和环路水平的机制还没有被很好地理解。
过去十年的研究已经阐明了在调节压力反应、焦虑和情绪调节方面连接情绪和认知控制中心的不同的大脑环路。例如,在人类中,当暴露于威胁刺激时,背内侧前额叶皮层(dmPFC)和杏仁核表现出兴奋性耦合,杏仁核-dmPFC环路的增强活动与焦虑的主观评级相关。与这些发现一致的是,啮齿类动物基底外侧杏仁核(BLA)激活前边缘前额叶皮层 (plPFC)(与人类dmPFC相似的啮齿类动物)的输入,会产生焦虑样行为,并在面对不确定性时对恐惧反应产生偏见行为。最近的研究也表明,BLA-plPFC的谷氨酸能突触在应激暴露后发生突触前强化。综上所述,这些数据表明,增强的杏仁核- dmpfc(啮齿动物中的BLA-plPFC)耦合可能代表了一种将压力暴露转化为焦虑样情绪状态的保守环路机制。然而,其分子机制有助于应力诱导的BLA-plPFC回路的增强和应激暴露后焦虑样行为的产生尚不清楚。在这里,研究人员阐明了一个eCB机制,将压力暴露与BLA-plPFC亚环路特异性突触强化和持续性焦虑样行为联系起来。
结果
1. BLA-plPFC电路具有应激反应性和抗焦虑性
为了研究调节BLA-plPFC连通性和可塑性的分子机制,研究人员首先验证了该环路是通过暴露于压力而参与的(图1A)。利用在体光纤光度法,研究人员观察到,不可预测的足底电击应激显著增加了激活plPFC的BLA轴突终末突触前Ca2+内流,并对休克开始起定时锁定作用(图1B和1C)。接下来,研究人员使用Inscopix在体超微显微成像技术对体内单细胞Ca2+成像来检测plPFC神经元对足底电击的反应。整个视野内神经元的Ca2+信号随电击暴露而增加(图1D和1E),随后的单细胞分析显示了三种不同的神经元种群:应激兴奋性(44.40%)、应激抑制性(38.43%)和应激无反应性(17.16%)(图1F和1G)。(兴奋性:|z| = 3.83,抑制性:|z| = 2.62,双尾t检验p = 0.0073),合成平均信号为兴奋性(z = 1.09;图1H),提示应激诱导的plPFC神经元兴奋多于抑制。这些数据表明,压力暴露参与了BLA-plPFC环路,并导致了plPFC神经元活性的增强。
压力暴露是焦虑障碍发展的普遍危险因素,啮齿动物的压力暴露可以模拟许多与情感性障碍相关的精神病理领域。事实上,在足底电击应激暴露24小时后,研究人员观察到在高架零迷宫(EZM)中焦虑样行为的增加(图1I)。为了测试是否可以通过直接激活BLA-plPFC环路来再现“应激样”状态,研究人员使用了一种交叉的化学发生方法来具体增强投射到plPFC的BLA神经元的兴奋性(图1J)。研究人员使用全细胞电流钳电生理学方法研究了氯氮平氮氧化物(CNO)应用后,plPFC投射的BLA锥体神经元表达的hM3D设计受体被设计药物(GqDREADD)激发的兴奋性动作电位(APs)特异性激活(图1K)。在BLA(图1L)和mPFC(图1M)中,给予CNO也可诱导cFOS的稳健表达。此外,尽管应激导致plPFC神经元的激活(图1 d和1 e),但在GqDREADD激活BLA-plPFC神经环路后,应激没有导致cFOS在BLA(n = 6,p = 0.6418)或plPFC (n = 6,p = 0.0855)的表达的进一步增加,表明应激和GqDREADD激活补充了重叠BLA-plPFC神经环路。在高架十字迷宫(EPM)中,该环路的化学发生激活显著增强了焦虑样行为(图1N)。这些数据表明,在小鼠中,BLA-plPFC回路是应激响应的,其激活是焦虑源性的,提示应激诱导的焦虑样行为可以通过增强BLA-plPFC环路功能来介导。
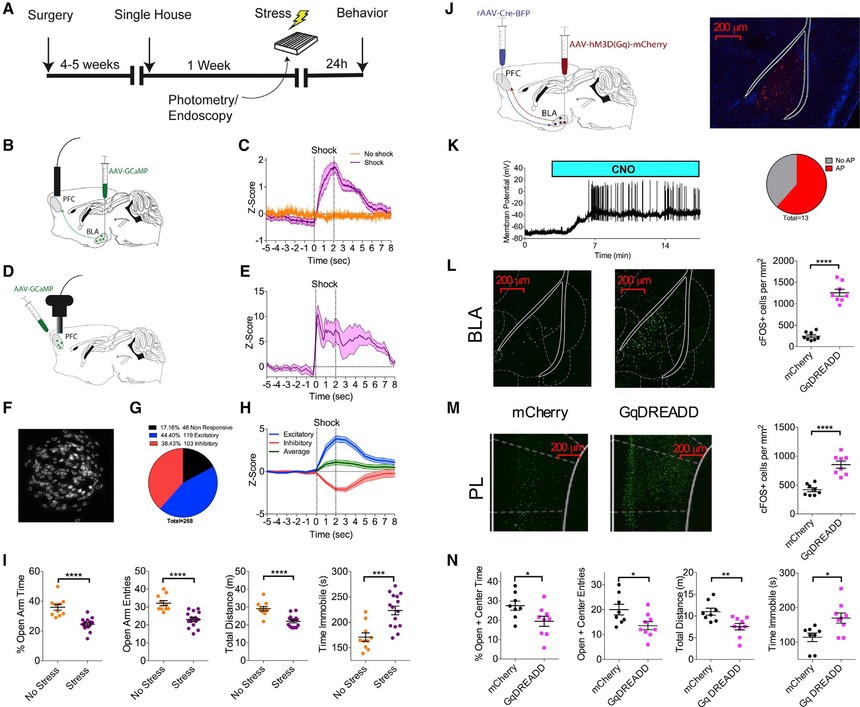
图1 压力暴露会激活焦虑性的BLA-plPFC回路







