两研究组揭示EGFR蛋白在活细胞质膜中的分布规律
2014年7月8日, 国际学术期刊Cell Research在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所季红斌研究组、许琛琦研究组与中国科学院长春应用化学研究所王宏达研究组的合作研究论文——"Regulation of EGFR nanocluster formation by ionic protein-lipid interaction"。在该项工作中,研究人员运用高分辨率显微成像技术,首次在单分子水平揭示了表皮生长因子受体(EGFR)蛋白在活细胞质膜中的分布规律——聚集形成团簇,并从蛋白-磷脂相互作用的新角度出发,阐明了酸性磷脂组分PIP2和EGFR近膜区碱性肽段在EGFR成簇分布和信号激活过程中的重要功能,解释了EGFR异常激活的新机制,并为解决耐药性提供了契机。
肺癌是当今世界上危害性最大的疾病之一。EGFR突变所引起的激酶过度激活对肺癌的发生发展具有重要贡献。EGFR突变以30%-50%的高百分比出现于东亚人群的非小细胞肺癌患者中。以EGFR为靶点设计的药物(比如小分子抑制剂吉非替尼和厄洛替尼)在临床上已得到广泛使用,并取得不错的治疗效果,但是耐药性的出现却极大削弱了靶向药物的功效,且目前并没有很好的对策。以前的研究工作大多集中于EGFR蛋白自身的结构和功能,却鲜有研究从EGFR蛋白所处的细胞质膜环境出发探索其对于EGFR激活的调控。因此,从新的视角去揭示EGFR激活的机制,有利于寻找解决耐药性的新策略。
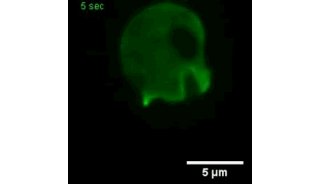
在该研究工作中,季红斌研究组的博士生汪烨、王宏达研究组的博士生高婧以及许琛琦研究组的博士生郭兴东通过合作首先运用直接随机光学重建显微成像技术(direct stochastic optical reconstruction microscopy, dSTORM),在单分子水平以高达~20 nm的分辨率观察了新鲜分离的肺癌细胞和正常肺上皮细胞表面EGFR蛋白的质膜分布模式。他们发现EGFR在两种细胞质膜中均聚集形成纳米团簇,且肺癌细胞表面的EGFR团簇在数量上更多,在大小上显著增大。
他们进一步结合光激活定位显微成像技术(photoactivated localization microscopy, PALM)对机制进行深入研究,发现质膜中的酸性磷脂组分PIP2参与介导了EGFR蛋白团簇的形成,而EGFR富含正电荷氨基酸的近膜区(JM区)能够通过结合PIP2分子与质膜发生离子型蛋白-磷脂相互作用,JM区的突变会显著抑制EGFR成簇。
最后,他们还揭示了EGFR成簇与其生物学功能之间的关系, PIP2水解或JM区的突变会破坏EGFR团簇的形成并遏制EGFR自身及其下游信号通路的激活。该研究工作从蛋白-磷脂相互作用的角度出发揭示了一种 EGFR激活过程的新机制,并暗示EGFR突变体很有可能会采取类似的成簇机制来增强信号转导。该研究为临床上EGFR靶向治疗新策略的提出奠定了理论基础。
该项工作得到了中国科学院、国家科技部、国家自然科学基金委、科技创新交叉与合作团队计划以及上海市科委的经费支持。
-
科技前沿
-
技术原理
-
项目成果

-
项目成果

-
焦点事件
-
焦点事件
-
焦点事件
-
项目成果