杨朝勇综述:肠道共生菌群和致病菌化学/生物学成像
肠道菌群作为一个新发现的“器官”,在影响宿主的生理病理活动中起着广泛而重要的作用。自本世纪初以来,肠道菌群的研究呈爆发式增长,但整个领域的研究过于依赖于DNA测序手段。成像技术因其独特的内在优势,在肠道菌群研究中具有重要的应用价值。利用成像技术,可观察肠道共生菌/致病菌在体原位的空间分布,也能够可视化研究细菌的微生物生长代谢活动以及细菌-宿主的免疫相互作用。然而,由于目前许多肠道细菌仍无法体外单独培养,极大限制了遗传操作工具在肠道菌群研究中的应用。近年来,国内外多个研究团队致力于开发适用于肠道细菌的化学/生物学成像工具,来破译这些高度复杂的肠道“暗物质”。
近年来,上海交通大学医学院杨朝勇/王炜团队在肠道菌群研究新兴领域,取得系列的重要进展:
(1)开发了基于抗生素的荧光探针,实现对复杂微生物群落中的革兰氏阴性/阳性菌的选择性荧光标记,并表现出临床应用的潜力;
(2)利用荧光D型氨基酸(FDAA)代谢标记探针,建立了首个可用于研究粪菌移植后植入菌存活情况的非测序方法,对于评估菌群移植效率、开发有效的菌群调控手段具有重要的参考价值;
(3)利用菌群在体DAA 代谢标记结合近红外II 区荧光染料,首次实现了小鼠肠道菌群的实时活体成像,为深入研究肠道菌群在体活动等问题提供了便捷的新工具;
(4)基于FDAA 双色序贯代谢标记与荧光原位杂交(Fluorescence in situ hybridization, FISH)技术相结合的研究策略,首次提出了一种独立于DNA测序之外的肠道细菌在体研究的新方法,为揭示肠道“暗物质”的在体生长代谢活性提供了新工具;
(5)基于FDAA代谢标记与组织透明化技术相结合的菌群成像新策略,展示了微米级的微生物在毫米级肠道组织中的原位三维空间信息,有望为深入研究肠道菌群和宿主的相对空间关系提供帮助。
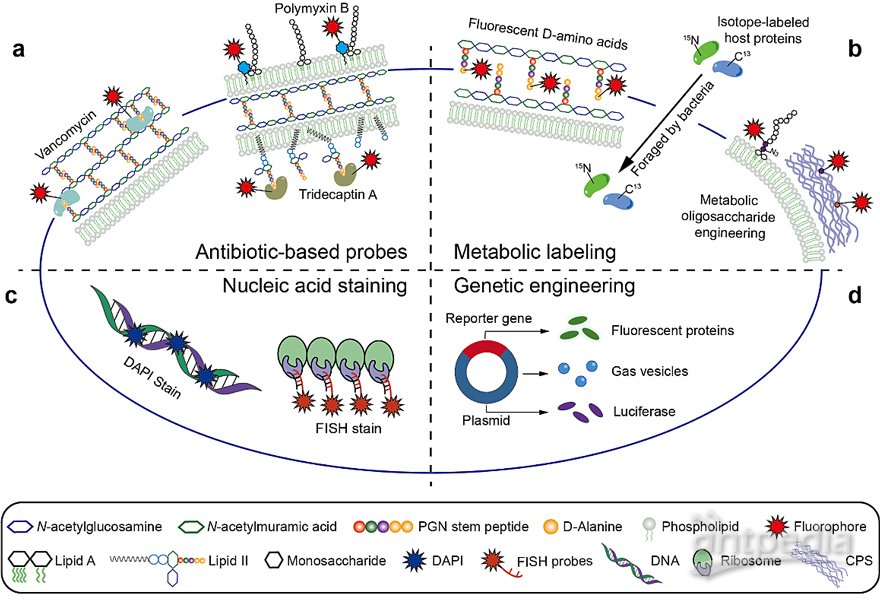
图1. 肠道细菌的化学/生物学成像工具。图片来源:Acc. Chem. Res.
鉴于以上的一系列创新性研究,杨朝勇/王炜团队受Accounts of Chemical Research 杂志邀请,发表了题为“Imaging Commensal Microbiota and Pathogenic Bacteria in the Gut”的综述论文,总结了近五年来该课题组和其他实验室在可视化研究肠道共生细菌和致病菌方面的最新进展,并系统性评述了这一新兴领域的研究现状、存在问题和发展趋势。文中从抗生素衍生的荧光探针、代谢标记策略、核酸探针以及荧光蛋白成像这四个方面详细阐述了菌群成像研究领域的最新进展。该综述可以启发和促进化学、生物、材料和医学等多学科在肠道菌群研究中的深度融合,对相关领域的科研人员具有一定的借鉴和参考价值。
该综述论文近期发表在Accounts of Chemical Research 杂志上,论文第一作者为上海交通大学医学院的博士研究生林丽缘,通讯作者为上海交通大学医学院的杨朝勇教授和王炜副研究员,该工作得到了国家自然科学基金、上海高水平地方高校创新团队的支持。
相关研究报道
Sci Adv | 杨朝勇/王炜团队发展肠道“暗物质”在体微生物行为研究新方法
人类生活与微生物密切相关,在自然界存在的细菌中,与人类关系最为密切的当属定植在消化道中的微生物群。近十几年来科学界对肠道菌群的研究呈爆发式增长,但整个领域的研究过于依赖于各类DNA测序手段,对于肠道细菌在体内的生长、代谢等微生物学过程知之甚少。只有对这些细菌的基础行为有了深入理解,才能真正深究菌群在宿主生理和病理过程中发挥的各类复杂功能。然而,由于目前许多肠道细菌在实验室中仍无法单独培养,导致人们对这部分菌群的了解还相当匮乏,因此称其为肠道中的“暗物质”。而那些能够在实验室中进行培养的肠道细菌,其在体外的研究结论能否完全反映其在体内的真实生物学行为,目前也仍存在一定争议。因此,在肠道菌群研究领域中非常需要能够直接在体探究肠道微生物活动的方法,以便了解其在体内原位的生长、代谢和繁殖情况。
2020年9月4日,上海交通大学医学院分子医学研究院杨朝勇,王炜团队在Science Advances在线发表了题为Revealing the in vivo growth and divisionpatterns of mouse gut bacteria的研究论文,利用D-型氨基酸在体序贯标记技术,结合使用荧光原位杂交(fluorescence in situ hybridization, FISH)探针,研究小鼠肠道中的各类细菌在体内的生长分裂方式,为揭开这些肠道“暗物质”的神秘面纱提供了首个可行的研究方法。

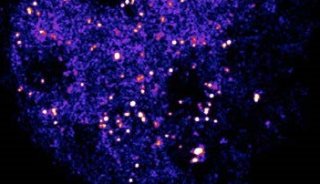
细菌细胞壁上的肽聚糖 (peptidoglycan) 在合成和代谢过程中,会通过青霉素结合蛋白 (penicillin binding protein,PBP) 的转肽酶结构域在其五肽结构末端的D-型氨基酸 (D-amino acid,DAA) 处发生替换 (与周围环境中的其他DAA) 、水解 (去掉最末端的D-丙氨酸) 等修饰,并且细菌的某些PBP对DAA的侧链上的基团有很高的容忍性。因而,如果在细菌生长环境中加入带有荧光基团的fluorescent DAA (FDAA) 探针,在其细胞壁的代谢过程中探针就可以被共价地连接到肽聚糖的寡肽结构中。由于绝大部分种类的细菌都存在较为保守的肽聚糖结构,因而在灌胃使用后,FDAA探针可以通过小鼠肠道细菌本身的生长代谢过程,实现对大多数肠道菌群的荧光标记。在此项工作中,研究人员序贯使用带有不同颜色的FDAA探针 (TADA, Cy5ADA) 灌胃,对小鼠的肠道菌群进行在体标记,以此使得绝大部分肠道细菌会同时带有两种荧光的标记信号。由于新合成的细胞壁区域会带有较强的第二探针信号,因此两种荧光在细胞壁上的分布可以反映细菌在标记过程中的生长分裂情况。随后,将盲肠的菌群样品分别使用靶向染色特定种属细菌的FISH探针,即可通过荧光成像明确各种细菌相应的生长分裂模式(图1),这其中也包括了尚无法在体外进行单独培养和研究的肠道细菌。
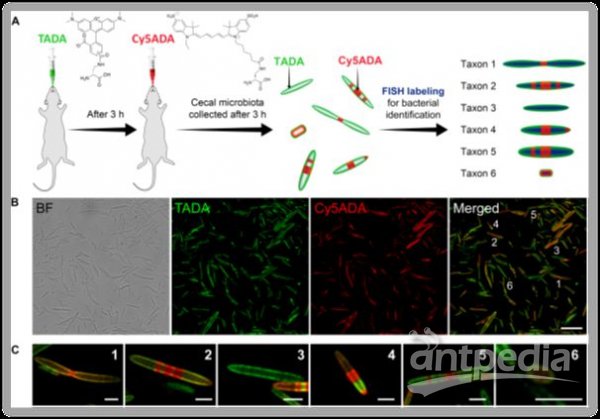
图1 FDAA序贯标记结合FISH染色示意图及肠道菌群双色荧光标记成像
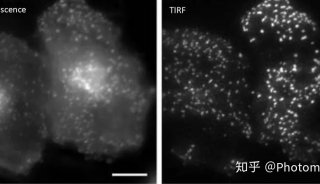
研究者分别观察了小鼠肠道内6种革兰氏阳性和6种革兰氏阴性菌属 (genus) 在体原位的生长分裂模式。并在此基础上,设计靶向特定细菌物种 (species) 的FISH探针,在种水平上观察不同细菌在体内的生长分裂情况, 其中明确了 6种不可培养细菌的分裂模式。此外,该团队还成像观察到分节丝状菌 (Segmentedfilamentous bacteria,SFB) 这一重要的免疫相关的肠道细菌在体内的生长分裂情况,利用双色荧光成像提供的微生物学信息,可以分析SFB细菌成熟分化过程的不同阶段,为研究SFB在体内的微生物活动提供了新的策略。
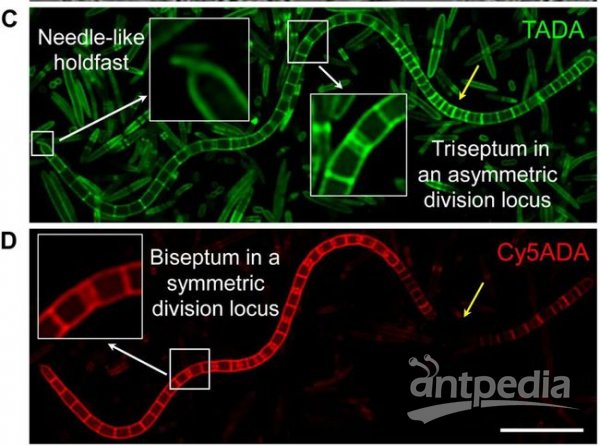
图2 FDAA序贯标记的SFB双色荧光成像图
此外,近期该团队还开发了可对肠道细菌在体的生长代谢活性进行直接定量的新方法。研究人员首先证明了FDAA的标记强度能够准确地反映细菌的生长代谢水平。通过灌胃FDAA在体标记各类肠道细菌后,结合FISH探针靶向菌群中感兴趣的特定种属,进而可利用流式细胞术分析该类细菌的FDAA荧光强度,从而对其在体的生长代谢水平进行直接定量。该团队将这一定量方法用于肠道菌群代谢活性的昼夜节律研究,发现小鼠肠道中革兰氏阳性菌在夜间生长代谢活跃,而革兰氏阴性菌则恰好相反,为理解菌群在体内的微生物活动规律提供了新的见解。该工作于2020年5月发表在德国应用化学 (Angew.Chem. Int. Ed. 59: 11923) 。

综合上述两个工作,该研究团队基于FDAA代谢标记与FISH染色,开发了可定性研究各类肠道细菌在体原位生长分裂方式的新策略,并可利用这一原理对肠道细菌在体原位的生长代谢水平进行直接定量,成功建立了一套独立于DNA测序之外的肠道细菌在体研究的新颖方法,为揭开肠道“暗物质”的秘密提供了新工具。
值得一提的是,近年来该研究团队利用其开发的FDAA在体代谢标记这一策略发展了多种肠道菌群研究的新策略。在19年发表的一项工作中 (Nat. Commun. 10: 1317) ,该团队与北京大学陈兴教授团队合作,应用FDAA序贯标记,提出了首个可用于研究粪菌移植(Fecal microbiota transplantation,FMT)后植入菌存活情况的非测序方法。研究者利用FDAA探针代谢标记供体小鼠的肠道菌群,在移植给受体小鼠后,利用带有第二种颜色的FDAA探针灌胃标记受体小鼠总体的肠道菌群,以此能够通过细菌上两种荧光信号的标记分布情况来判断植入菌在受体内的存活情况 (存活下来的植入菌应当同时带有两种颜色的FDAA标记) 。此外,该研究团队与交大医学院谭蔚泓教授团队合作,基于FDAA代谢标记策略,结合使用近红外二区 (NIR-II) 染料,首次实现了肠道菌群的实时活体成像(Angew. Chem. Int. Ed. 59:2628) ,为可视化观察体内深层组织中的各类细菌提供了一个便捷的研究工具。
原文:https://advances.sciencemag.org/content/6/36/eabb2531