钦伦秀团队揭示肝癌免疫逃逸新机制
肿瘤免疫治疗是近年来癌症治疗领域的重大进展,靶向阻断 PD-1/PD-L1免疫检查点抗体疗法在癌症免疫治疗中更是具有里程碑式的意义。目前,美国FDA批准的PD-1抗体药物nivolumab(英文商品名: Opdivo)和pembrolizumab(英文商品名: Keytruda)与常用的抗癌药多吉美(索拉非尼sorafenib)联用用于治疗肝癌有一定的效果【1,2】,然而由于原发性/继发性耐药问题、免疫逃逸以及抗体药物有效性的问题,目前肝癌患者治疗的生存率并没有显著增加。如何提高有效率、克服耐药是研究的热点与难点。癌细胞与微环境相关对话,通过“免疫编辑”等途径,营造抑制性免疫微环境,从而发生免疫逃逸,是影响免疫治疗疗效的重要方面。因此,寻找新的方法提高肝癌免疫治疗途径具有重要意义。
近日,复旦大学钦伦秀、董琼珠团队与美国MD安德森癌症中心教授洪明奇团队合作在Gut杂志上发表了题为Disruption of tumour-associated macrophage trafficking by the osteopontin-induced colony-stimulating factor-1 signalling sensitises hepatocellular carcinoma to anti-PD-L1 blockade的研究成果,研究揭秘了肝癌免疫逃逸的新机制,发现了提高肝癌免疫治疗疗效的新途径。

近年来,钦伦秀团队相继在Cancer Cell、Cell Metabolism和Hepatology等期刊发表癌转移研究成果发现,OPN(osteopontin, 骨桥蛋白)是促进肝癌转移的重要基因,可用于肝癌转移复发的预测与监测,并发现微环境炎症免疫反应失衡(Th1/Th2偏移)促进肝癌转移,其中集落刺激因子1(colony-stimulating factor-1,CSF1)是“元凶”。
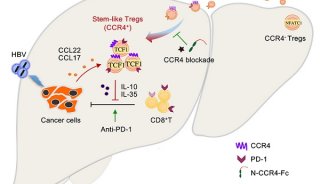
在上述研究成果基础上,钦伦秀团队联合洪明奇团队通过应用OPN敲除小鼠、不同转移细胞系、动物模型和临床样本等,进一步研究发现肝癌细胞来源的过量OPN通过PI3K-AKT-p65通路刺激巨噬细胞分泌CSF1,激活巨噬细胞CSF1/CSF1R通路,促进巨噬细胞趋化及M2型极化,促进Th1/Th2偏移,并上调肝癌细胞PD-L1的表达,营造抑制性免疫微环境,导致肝癌免疫逃逸。

进一步发现,使用CSF1受体抑制剂(PLX3397)后,可显著抑制肿瘤内肿瘤相关巨噬细胞浸润、增加肿瘤内CD8+T淋巴细胞浸润和杀伤活性,重塑肝癌微环境,协同增强免疫检查点PD-L1抗体的疗效。该研究为肝癌患者的个体化免疫治疗提供了新思路,有望成为免疫治疗防治术后转移复发的新策略。
据悉,钦伦秀、董琼珠和洪明奇为本文的共同通讯作者,附属华山医院普外科朱迎等为本文的第一作者。
注:上述内容主要引自复旦大学官网,有改动和补充。
原文链接:
https://gut.bmj.com/content/early/2019/03/22/gutjnl-2019-318419.long
参考文献:
1、el-Khoueiry aB, Sangro B, Yau t, et al. nivolumab in patients with advanced hepatocellular carcinoma (checkMate 040): an open-label, non-comparative, phase 1/2 dose escalation and expansion trial. Lancet 2017;389:2492–502.
2、Zhu aX, Finn rS, edeline J, et al. Pembrolizumab in patients with advanced hepatocellular carcinoma previously treated with sorafenib (KeYnOte-224): a nonrandomised, open-label phase 2 trial. Lancet Oncol 2018;19:940–52
-
科技前沿
-
项目成果

-
项目成果
-
焦点事件