药物研发的好帮手—蛋白质表达系统
近年来,随着生物药市场和基因工程技术的发展,重组治疗性抗体或者单抗的需求在生物药中的比例也逐年上升。重组mAbs被应用于包括癌症及免疫系统缺陷在内的许多疾病的治疗当中。
重组mAbs通过基因工程技术改造后可以在多种宿主细胞表达。重组mAbs在表达后进行翻译后修饰、蛋白质折叠、组装及适当的糖基化才能具有生物学活性。由于各种生物的特性不同,适合表达蛋白的种类也不相同,不同宿主产生的mAbs,其生物活性和免疫原性也都各不相同。
大肠杆菌(E.coli)表达系统
在各种表达系统中,最早被采用进行研究的是大肠杆菌(E.coli)表达系统,其显著的优点是易于操作,产量高,成本低,但是由于用E.coli生产的蛋白在蛋白质翻译后缺乏加工机制,如二硫键的形成、蛋白糖基化和正确折叠,在人体内易被降解,得到具有生物活性的蛋白的几率较小。此外,E.coli还易产生内毒素超标和包涵体等问题。
哺乳动物细胞表达系统
目前所有哺乳动物细胞表达系统中,中国仓鼠卵巢(CHO)细胞应用最为广泛,由于其酷似人类的翻译后修饰和内在的蛋白质折叠机制的优点,是重组mAbs生产的首选平台,占据了70%的重组mAbs生产制备,并且大部分为单克隆抗体。为了在早期治疗性研究中得到毫克到克级的蛋白质,蛋白瞬时表达系统被广泛应用,目标蛋白均可以在5-8周内提供。这种快速的蛋白制备技术与稳定细胞株构架相比,大大缩短了研发周期,从而促进了生物治疗药物的研发进程。
根据目的蛋白表达的时空差异,可将哺乳动物细胞表达系统分为瞬时和稳定表达系统。
1、瞬时表达系统是指以外源基因导入宿主细胞(转染)为基础,在有限的时间内表达的技术。转染后,质粒DNA分子留在细胞内,不整合到基因组中,最终随着时间的推移和细胞分裂而丢失。在抗体上清收获之前,抗体上清的制备生产通常限于转染后7-14天,时间比较短暂。瞬时表达系统的优势是操作过程简捷,实验周期短。另一个显著的优势是瞬时表达的灵活性。只有改变质粒DNA中包含的目的基因,就可以表达几种蛋白质,灵活性比较高。这些优势让瞬时表达系统在抗体药物早期的高通量筛选流程中承担了很重要的角色。当目的蛋白或者抗体由于毒性问题而不能让细胞持续表达时,瞬时表达也是一种合适的选择[1,2]。此外,瞬时表达可以从非常小的规模(96孔板)[3]扩大到大容量培养容器中(生物反应器中的数百升)[4]。
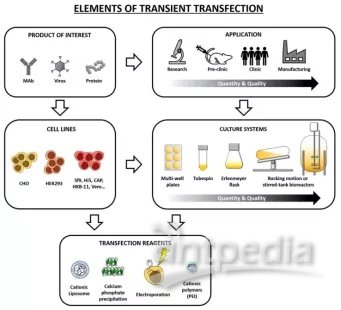
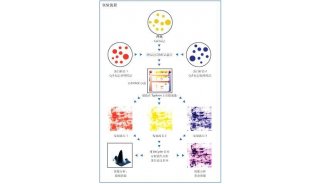
图1.瞬时转染元件[5]
2、稳定表达系统是指载体进入宿主细胞,经过选择加压筛选培养,载体DNA稳定整合在细胞内,目的蛋白的表达持久、稳定。由于需要抗性筛选、加压扩增等步骤,稳定表达相对实验周期长,耗时耗力。
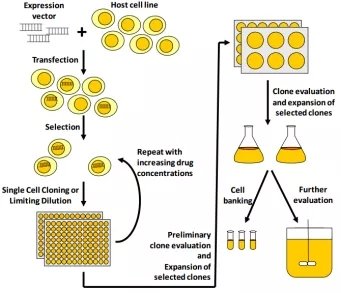
图2.稳转细胞系构建流程[6]
生物医药界“糖宝”-CHO
1957年美国科罗拉多大学的Puck教授从一成年雌性仓鼠卵巢分离获得一种上皮贴壁型细胞,并建立了首批CHO细胞系,为命名为CHO-K1细胞系,是目前在生物领域中广泛使用的细胞系[7]。,此后建立了许多不同的细胞系,如CHO-S、CHOK1SV、DG44等[8]。
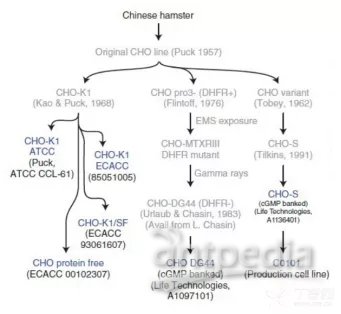
图3.CHO细胞发展[9]
1、CHO细胞的应用优势
那么为什么CHO细胞这么受大家的喜爱呢?不仅是因为为它具有稳定传代不死的性质,它还具有下面几大优势,让新药研发行业的同仁们对它爱不释手。
1)具有清晰地历史背景和监管机构的认可,安全性高;
2)具有准确的转录后修饰功能,表达的蛋白在分子结构、理化性质和生物学功能等方面最接近于天然蛋白分子;
3)既可以贴壁生长,又可以悬浮培养,并且具有较高的耐受剪切力和渗透压的能力;
4)具有重组基因的高效扩增和表达能力,外源蛋白整合稳定;
5)具有产物胞外分泌的功能,并且很少几乎不分泌自身的内源蛋白,便于下游产物的分离与纯化;
6)能以悬浮培养方式或者在无血清培养基中达到高密度培养,可以大规模生产。
2、改善CHO细胞的表达水平
近年来,研究人员和细胞开发公司已经开发了许多策略来改善CHO细胞表达水平。表达EBNA1蛋白或T抗原的CHO细胞系,其制备抗体的能力会得到增强。还有其它CHO细胞系基因工程策略,例如过表达未折叠蛋白应答因子或敲除促凋亡基因,也可以显著地增加CHO细胞的表达能力。表达工艺的优化,如化学添加,温度偏移,或更长的培养时间等方法,均可以增加其表达水平。
针对于转染效率、生产力和生长特性,很多产品公司对CHO细胞进行改造及优化,目前被应用CHO-S细胞系,商品名为ExpiCHO-STM。ExpiCHO-S细胞经悬浮培养后,呈最小的聚集趋势,在表达培养基中呈高密度生长,能显著提升瞬时表达的产量和效率。稳定的细胞系表达能力,稳定的产品质量和较高的产率,CHO细胞表达系统已成为生物制药工业中制备大量蛋白质的首选方法。相信在不久的将来,有更多高质量的重组mAb通过CHO细胞制备出来。
参考资料:
[1] Nallet S, Amacker M, Westerfeld N, et al. Respiratory syncytial virus subunit vaccine based on a recombinant fusion protein expressed transiently in mammalian cells. Vaccine. 2009;27:6415–6419.
[2] Mignaqui AC, Ruiz V, Perret S, et al. Transient gene expression in serum-free suspension-growing mammalian cells for the production of foot-and-mouth disease virus empty capsids. PLoS One. 2013;8:1–9.
[3] Raymond C, Tom R, Perret S, et al. A simplified polyethylenimine-mediated transfection process for largescale and high-throughput applications. Methods. 2011;55:44–51.
[4] Tuvesson O, Uhe C, Rozkov A, et al. Development of a generic transient transfection process at 100 L scale. Cytotechnology. 2008;56:123–136.
[5] Gutiérrez-Granados S, Cervera L, Kamen AA, et al. Advancements in mammalian cell transient gene expression (TGE) technology for accelerated production of biologics. Crit Rev Biotechnol. 2018 Sep;38(6):918-940.
[6] Lai T1, Yang Y, Ng SK. Advances in Mammalian Cell Line Development Technologies for Recombinant Protein Production. Pharmaceuticals (Basel). 2013 Apr 26;6(5):579-603.
[7] PUCK TT. The genetics of somatic mammalian cells. Adv Biol Med Phys. 1957;5:75-101.
[8] Stolfa G1, Smonskey MT, Boniface R. CHO-Omics Review: The Impact of Current and Emerging Technologies on Chinese Hamster Ovary Based Bioproduction. Biotechnol J. 2018 Mar;13(3):e1700227.
[9] Lewis
NE, Liu X, Li Y, et al. Genomic landscapes of Chinese hamster ovary
cell lines as revealed by the Cricetulus griseus draft genome. Nat
Biotechnol. 2013 Aug;31(8):759-65.