Nature子刊:血管内皮细胞分泌机制新发现
来自北京大学分子医学研究所罗金才课题组在血管内皮细胞分泌的调控机制研究中取得重要进展。相关研究成果以“Zyxin regulates endothelial von Willebrand factor secretion by reorganizing actin filaments around exocytic granules”(Zyxin通过重构包绕分泌囊泡的微丝网络调控血管内皮细胞分泌血管性血友病因子)为题于2017年1月17日在线发表在Nature Communications上。
北京大学分子医学研究所罗金才教授及中国科学院生物物理研究所李栋研究员为文章的共同通讯作者,韩晓帆博士和李品博士为共同第一作者。
内皮细胞位于血管壁的最内层,介于管壁与血液之间。基于这种独特的位置,内皮细胞在响应外界刺激、维持循环系统稳态中起重要作用,其中分泌功能是内皮细胞应对刺激的一种重要手段。Weibel palade小体(WP小体)是血管内皮细胞特有的分泌囊泡,储存有多种凝血和炎症相关因子,如von Willebrand因子(vWF)等。揭示内皮细胞分泌的分子调控机制,对防治出血、炎症等相关疾病具有重要意义。
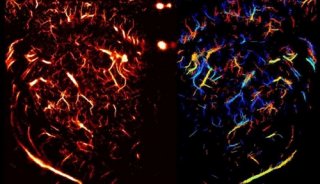
罗金才课题组最新研究发现细胞黏附斑分子Zyxin是一个全新的WP小体分泌调控分子,下调人原代血管内皮细胞的Zyxin基因能显著抑制cAMP激动剂引起的vWF分泌;且Zyxin基因敲除小鼠呈现出血时间延长、血栓形成减慢等表型,揭示Zyxin介导的内皮细胞分泌功能对血管损伤修复和血栓形成起到不可或缺的作用。进一步采用活细胞超高分辨率成像系统显示,Zyxin及其结合蛋白α-actinin对细胞膜下囊泡周围的微丝分子网络进行重构,通过形成环状“脚手架”结构来精确调控囊泡的分泌。
这一研究不仅发现了调节内皮细胞分泌的新型分子Zyxin,提供了治疗出血及血栓性疾病的潜在靶标,而且首次在活细胞中观察到膜下微丝分子网络与囊泡的相互作用,提出了具有广泛意义的骨架调节囊泡分泌新模型,为今后研究囊泡和骨架的作用及机制提供了新思路。
-
科技前沿
-
焦点事件