离体叶绿体的制备以及完整度的测定
实验概要
分离方法一般有两种,一是酶消化方法,把叶片表皮撕去后,用纤维素酶和果胶酶消化细胞壁,得到原生质体,再把原生质体通过尼龙网小孔(孔径20μm),使原生质体破裂而释放出完整叶绿体,但此方法分离得到的叶绿体数量有限。另一种是用机械方法,先用捣碎机破碎叶片,再分步离心,可以大量制备叶绿体。这里主要介绍离心法分离完整叶绿体。
实验原理
叶绿体是植物进行光合作用的细胞器,分布在叶肉细胞内(组成气孔的保卫细胞也含有叶绿体)。叶绿体是由被膜、间质和类囊体三部分组成。依据分离所得叶绿体的结构完整程度,大致将叶绿体分成两类:一类为被膜已破碎的叶绿体,称之为破碎叶绿体,它具有光合电子传递、光合放氧和光合磷酸化的功能;另一类为被膜完整的叶绿体,它具有同化二氧化碳的完全的光合作用功能。分离和制备有活性的离题叶绿体是研究叶绿体的结构功能、光合作用原理及遗传控制机理的前提。要分离有活性、较纯的完整叶绿体相当困难,有些植物叶片细胞的细胞比较厚,叶绿体不易从细胞中分离出来;有些植物叶绿体外膜极易破损,有些植物叶片细胞中含有某些内源性抑制物质。例如:水解酶、氧化酶等,在制备过程中极易释放出来,破坏叶绿体的结构和活性。因此,不是所有的高等植物都适合用来分离和制备叶绿体,最常用的植物材料有菠菜、豌豆、玉米、甜菜、大麦等。此外,低等植物如衣藻、小球藻等也是常用的材料。叶绿体遗传转化技术作为一项新技术近年来为植物基因工程提供了一条新途径。但叶绿体一旦离体,其翻译活性在15~30min 后就可能完全丧失。叶绿体是绿色植物细胞中典型的细胞器,可通过研磨叶片并匀浆后,根据其颗粒大小经过滤、差速离心加以分离。分离叶绿体应在等渗溶液中制备,以减少渗透压对叶绿体的伤害。整个分离过程应在0~4℃下进行,所有提取物、溶液和材料,也应保存在该温度下备用。叶绿体活力会随着离体时间延长而不断下降,因此,分离工作应尽可能在短时间内完成。
主要试剂
1. 提取液:含0.33mol/L山梨醇,0.05 mol/L MES (pH 6.1),0.01 mol/L NaCl,2mmol/L MgC12,2 mmol/L EDTA-Na2,0.5 mmol/L KH2P04,2 mmol/L抗坏血酸钠(抗坏血酸钠宜在使用前现配现加)
2. 涨破叶绿体的Hill反应速率测定液:0.05 mol/L Tris-HCl(pH 7.6),5 mmol/L MgCl2,10 mmol/L NaCl,10 mmol/L K3Fe(CN)6。10 mmol/L NH4C1
3. 0.66 mol/L山梨醇
4. Percoll(一种具有高密度和低渗透势的二氧化硅溶胶) percoll本身是低渗透压的,要用高渗透压溶液配成生理等渗透压溶液,然后使用,不然,细胞容易破裂。一般是先用9份Percoll与1份8.5% NaCl或1.5MPBS混合达到生理性渗透压,然后用生理溶液(0.85% NaCl或0.15M PBS)稀释到所需浓度。即取Percoll原液与10倍浓缩的PBS以9:1的比例混合,此时溶液 为100% Percoll,比重是1.127,毫克分子渗透压浓度为290mOsmol/kg。
Percoll浓度(%) | 70 | 60 | 50 | 40 | 30 | 20 |
比重g/ml | 1.090 | 1.077 | 1.067 | 1.056 | 1.043 | 1.031 |
主要设备
普通离心机(需带有水平离心头),或低温离心机、电动捣碎器、照光装置、氧电极测氧装置等。
实验步骤
1. 采摘新鲜菠菜或豌豆叶片
菠菜要选择嫩而厚,无显著皱纹的叶片,最好在早晨摘取,以免日照后在叶绿体内积累淀粉,不利于完整叶绿体的分离。豌豆也要选择嫩而厚的叶片,摘取后应尽快使用。叶片先在强光下照射15~20min,用以激活叶绿体,尤其用在完整叶绿体的以二氧化碳为底物放氧活性测定时,能使其缩短光合作用诱导期。为了防止强光照射下的温度上升,可把叶片铺放在冰块上,并在光源与叶片之间放隔水层。
2. 叶绿体制备
叶片去除叶柄及中脉后,以每10g叶片约加20~30ml冰冷的提取液。在电动捣碎器上高速捣碎,约2s/次,间隔捣碎3~4次,使叶片碎成绿豆粒样大小,然后经4层纱布过滤,去除残渣。注意过滤时不可用力挤压,以免叶绿体被膜破碎。滤液以1000×g离心,4℃,将离心管放人离心机后,使离心机的加速很快上升到预定值,经约30s后再很快使其下降停止,整个离心程序大约用2~3min左右完成。小心地倒出上清液,先用少许提取介质漂洗去沉淀表面的浮物,再加入悬浮介质:即把提取介质中的MES换成HEPES(pH7.6),悬浮叶绿体,在分散叶绿体沉淀时宜使用毛笔轻轻刷之,或者用手握住离心管,在冰块之间搅动,使叶绿体由于振动而分散开来,不要用棉球吸滤,以防被膜压破。叶绿体悬浮时要浓一些(含叶绿素2 mg/ml以上),这样有利于其活性的保持。
3. 叶绿体被膜完整率的进一步提高
上述方法所得叶绿体被膜完整率一般约在60%左右,好的时候也可达到70%以上。如果需要进一步提纯,一种简单的方法是再次用悬浮介质洗涤叶绿体,并用同样离心方法沉淀叶绿体,把破碎的叶绿体漂洗去,起着浮选作用,但用此方法提高被膜完整率的程度有限,而且叶绿体损失也多。另一种方法是用Percoll作为密度梯度介质,方法是将3m1含有80% Percoll(以原液为100%浓度,用水稀释),铺在10ml体积的离心管下层,再把3m1 40%Percoll铺在离心管的中层,然后将lml叶绿体悬浮液轻轻地铺在离心管的上层,用水平离心头的离心机在1500×g下离心2~3min,注意此时离心机的加速一定要缓慢上升,而下降时也要缓慢停下,否则会破坏Percoll的浓度梯度层的形成,取出离心管可以看到有3层绿色带,最上层的为破碎叶绿体,沉在底层的为粗颗粒,而40%~80% Percoll之间的界面上有一绿色层,是完整叶绿体,小心地将它吸取出来,转移到叶绿体悬浮介质里。此部分叶绿体的被膜完整率可达95%以上,有时甚至100%。Percoll介质可以重复使用,把密度梯度离心用过以后的40%和80% Percoll,分别吸取出来,存储于冰箱中以备下次使用。如果制备完整叶绿体的目的只是为了供叶绿体DNA的分离所用,则主要获得被膜完整率高的叶绿体制剂即可,不必考虑叶绿体同化二氧化碳的活性,因此提取介质可改用简单的STN溶液,但是操作顺序需按照制备完整叶绿体的方法,再用Percoll作密度梯度离心提纯。
叶绿体被膜完整率的测定:
由于铁氰化钾不能透过叶绿体被膜,故完整叶绿体在等渗条件下不能进行铁氰化钾光还原的反应,而被膜破碎的叶绿体,铁氰化钾可进入叶绿体进行反应,利用此原理来比较被膜破碎与未破碎叶绿体的Hill反应速率的差别,就可测出叶绿体中被膜的完整率。被膜未破的叶绿体的Hill反应速率测定,是将上述被膜涨破叶绿体的Hill反应速率测定液,先以1:1体积与0.66 mol/L山梨醇混合,使之保持0.33 mol/L山梨醇浓度,再加入叶绿体(每毫升反应液约含叶绿素50μg),用氧电极方法测定Hill反应速率(参阅氧电极测氧方法)。被膜破碎的叶绿体Hill反应速率测定,是先与不含山梨醇的Hill反应液混合,使被膜在低渗介质下胀破,再以1:1体积与0.66mol/L山梨醇混合,使测定时也保持0.33mol/L山梨醇浓度,在相同条件下测定Hill反应速率。被膜完整率的计算如下:
被膜完整率(%)=[(被膜涨破叶绿体的Hill反应速率-完整叶绿体的Hill反应速率)/被膜涨破叶绿体的Hill反应速率 ]×100
测定计算实例见下图:
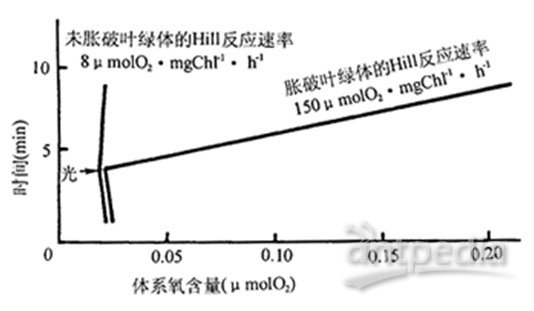
用铁氰化钾作Hill氧化剂检测叶绿体完整度记录图
被膜完整率(%)=(150-8)/150=94.7%
4. 实验结果 按照上述的图表记录实验结果并计算。
附 件 (共1个附件,占21KB)
![]()
4.jpg
21KB 查看