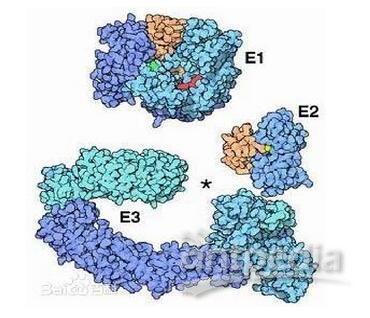
Cell:去泛素化与膜蛋白调控机制
内质网相关的降解过程能清除错误折叠蛋白的分泌途径,同时介导一些内质网残留蛋白的调控降解过程。研究发现一种蛋白与一种泛素连接酶之间相互作用的细微增加,都能引发信号底物的降解,一项最新的研究解析了其中的作用机制,指出去泛素化可以作为一种信号放大器,放大信号,从而进行下游调控。这一研究成果公布在Cell杂志上。
新合成的膜蛋白需要泛素连接酶复合物检测,走向降解与非降解的两条命运,但是经过多年研究,科学家们对于这一过程中底物-连接酶之间的相互作用,出现的细微差别如何会造成了完全不同的最后结果的作用机制,并不清楚。
为此研究人员利用来自病毒介导的降解途径中的纯化组分,重构了脂质体中膜蛋白识别过程,以及泛素化过程。由此发现膜上的底物-连接酶之间的相互作用,能够直接影响泛素组件调节多泛素化的过程。其中令研究人员感到惊讶的是,就是这种差异过程还不能解释培养细胞中降解和非降解的不同命运。
因此之后研究人员又通过计算机模拟,实验分析发现持续的去泛素化是最大底物差异的一个先决条件,去泛素化酶能降低多泛素化停留时间,从而更快释放底物和酶,这解释了底物-酶之间相互作用的微小差别,能被放大到降解的这种更大差异。这些研究结果为膜蛋白质量控制机制提出了一种底物差别的新框架,揭示了一种膜蛋白降解的新作用机制。
泛素化作用与多个研究方向有关,因此吸引了不少科学家致力于这一方面的研究,比如近期一组研究人员研发出了一种能靶向泛素系统中多种酶的研究方法,并指出泛素的动力学相互作用,能用于发现泛素系统中主要酶的选择性调控元件,从而通过之前未受关注的一泛素研究领域,揭示了泛素系统作用的新机制。
研究人员提出了一种能靶向泛素系统中多种酶的研究方法,他们利用大量泛素突变的组合库,研发了四种DUBs的抑制剂,并通过结晶学方法分析了DUB 抑制复合物,从而延伸了E2和E3酶的筛选策略,发现泛素突变也能增强酶的活性。由此研究人员指出,泛素突变体能选择性结合泛素结合结构域,这种细胞中泛素突变体的选择功能,有助于泛素系统中特异性酶反应的正交调控。
由此研究人员构建出泛素突变体组合库,这种泛素突变也能增强酶的活性。通过优化泛素和泛素系统中的酶之间的相互作用,研究人员就能发现泛素系统活性选择性调控元件。