2019年10月HIV研究亮点进展
人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
即将过去的10月份,有哪些重大的HIV研究或发现呢?生物谷小编梳理了一下这个月生物谷报道的HIV研究方面的新闻,供大家阅读。
1.Cell:重大进展!开发出比CAR-T细胞更安全、用途更广的cCAR-T细胞技术
doi:10.1016/j.cell.2019.10.002
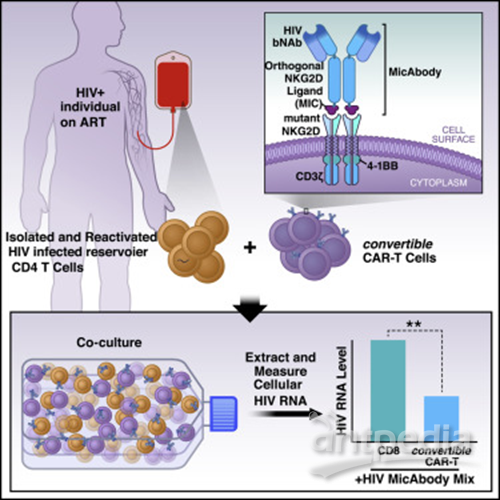
在一项新的研究中,来自美国格拉斯通研究所和Xyphos生物科学公司(Xyphos Biosciences, Inc.)的研究人员描述了一种攻击被HIV感染的细胞的新技术。这种新技术是CAR-T细胞免疫疗法的一种新的改进版本。近年来,这种疗法因在抵抗血癌上取得的成功而闻名于世。通过改进使得它具有更大的覆盖范围和多功能性,这种称为convertibleCAR T细胞(cCAR-T)的新技术在多个治疗领域显示出了巨大的前景,特别是在抗击HIV方面,这是因为它可以用来缩小在接受抗逆转录病毒疗法(ART)期间HIV感染者体内持续存在的受感染细胞的库存量。相关研究结果于2019年10月24日在线发表在Cell期刊上,论文标题为“Attacking Latent HIV with convertibleCAR-T Cells, a Highly Adaptable Killing Platform”。论文通讯作者为格拉斯通研究所HIV治愈研究中心主任Warner C. Greene博士。
图片来自Cell, 2019, doi:10.1016/j.cell.2019.10.002。
人们已证实传统的CAR-T细胞在诱导血癌(比如淋巴瘤和儿童白血病)缓解方面非常成功。但是作为抵抗HIV感染的疗法,传统的CAR-T细胞并不完美。论文第一作者、Greene实验室科学家Eytan Herzig说,“传统的CAR-T细胞的一些缺点是它们经过基因改造后靶向癌细胞表面上的单个分子,而且一旦被注射到患者体内,无法对它们进行控制。”
Xyphos生物科学公司通过从细胞毒杀伤细胞中分离出靶向抗体克服了这些缺陷。该公司首席科学家David W. Martin博士解释说:“我们对cCAR-T细胞进行了基因改造,使得这些T细胞可以在其表面上表达受到少量修饰的人类受体蛋白NKG2D。”这种受到修饰的NKG2D受体当与它的搭档结合时,可以将这些T细胞变成有效的杀手。它的搭档是一种叫做MIC-A的蛋白质,Xyphos生物科学公司的科学家对它进行了裁剪和修饰,使得它可以与cCAR-T细胞表面上这种经过修饰的NKG2D受体特异性结合。这些科学家随后将它与靶向抗体的底部融合在一起,从而构建出他们称为MicAbody的产物。因此,这种靶向性MicAbody紧密地和唯一地结合cCAR-T细胞。
为了清除潜伏性HIV病毒库,Herzig和Greene一直在实验室中测试称为广泛中和抗体(bNAb)的抗HIV抗体。他们与Xyphos生物科学公司的科学家合作,基于bNAb构建出MicAbody(称为Mic-bNAb),并在各种实验室分析中测试了cCAR-T细胞和Mic-bNAb的组合使用。
在实验室中,Herzig以感染了各种HIV毒株的多种CD4 T细胞(HIV的天然靶标)为研究对象测试了这些组合。特别是,他使用了源自人类扁桃体的细胞制剂;已知在HIV感染者中,扁桃体T细胞是潜伏性HIV病毒库。他想确保cCAR-T/Mic-bNAb组合使用能杀死代表潜伏性HIV病毒库的T细胞类型。
结果是显著的:cCAR-T细胞与Mic-bNAb的组合使用特异性地杀死了受到感染的CD4 T细胞,但未杀死未感染的细胞。它们仅与Mic-bNAb组合使用时才杀死受感染的细胞,然而,不论是单独使用还是与不靶向HIV的MicAbody组合使用都没有这种效果。他们杀死了在实验室中感染了多种HIV毒株的CD4 T细胞。当与靶向HIV的Mic-bNAb和靶向癌细胞的MicAbody组合使用时,cCAR-T细胞可以有效杀死在相同细胞培养物中混合在一起的癌细胞和受到HIV感染的细胞。换句话说,cCAR-T细胞精确地证明了它旨在实现的多功能性和特异性。
最后,Herzig和Greene测试了cCAR-T/Mic-bNAb平台是否可以攻击接受ART治疗的HIV感染者血液中存在的潜伏性HIV病毒库。为了让这些细胞对cCAR-T细胞可见,他们首先用强效的称为“潜伏逆转剂(latency-reversing agent)”的化合物活化这些细胞培养物。在接触后48小时内,一半以上活化的表达HIV靶抗原的细胞被清除。Greene总结道,“这个平台前景广阔。”
2.NEJM:世界首例!中国科学家找到治疗艾滋病和白血病新方法!
doi:10.1056/NEJMoa1817426
近日,一项刊登在国际杂志The New England Journal of Medicine上的研究报告中,来自北京大学-清华大学生命科学联合中心邓宏魁研究组、解放军总医院第五医学中心陈虎研究组及首都医科大学附属北京佑安医院吴昊研究组的研究人员通过联合研究发表了题为“CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia”(利用CRISPR基因编辑的成体造血干细胞在患有艾滋病合并急性淋巴细胞白血病患者中的长期重建)的研究论文,这项研究成果标志着世界上首例通过基因编辑干细胞治疗艾滋病和白血病患者的案例由我国科学家成功完成了!
我们都知道,如今CRISPR-Cas9基因编辑工具对哺乳动物细胞的基因组进行编辑已经被广泛使用了,该技术展现出了潜在的临床使用前途,而且目前研究人员已经开始利用该技术来探寻基于CRISPR的疗法治疗人类疾病的安全性和可行性。CCR5是HIV-1感染人体的一个保护性靶点,CCR5缺失的血细胞常常对HIV-1的感染有很大的抵抗力;有研究表明,当将携带天然CCR5突变的造血干细胞和祖细胞(HSPCs,hematopoietic stem and progenitor cells,造血干祖细胞)进行同种异体移植后(allogeneic transplantation)就能长期根除HIV-1,因为CCR5是HIV进入机体的关键共受体,这些事例或许就增加了一种可能性,即移植携带人工破坏CCR5的细胞或能作为一种新方法来制造对HIV-1感染耐受的细胞。
中国科学家的这项最新研究描述了同种异体干细胞移植后CCR5 CRISPR基因编辑的CD34+细胞的长期移植状况,其对循环骨髓细胞基因组的基因干扰比率不到8%,而且并不存在基因编辑的脱靶效应。这项长达多年的工作目前已经初步证实了基因编辑造血干细胞在临床应用中的可行性与安全性,未来将会促进和推动该技术的临床应用。未来研究人员将会继续深入研究通过各种方法来优化基因编辑造血干细胞移植方案,从而降低脱靶率,实现100%的CCR5的敲除效率。
3.Science子刊:对潜伏性HIV病毒库形成的新见解有助于开发出更好的疗法
doi:10.1126/scitranslmed.aaw5589
抗逆转录病毒疗法(ART)可以将HIV病毒抑制到几乎无法检测到的程度,并且接受这种药物治疗的人可以活很多年。但是这种治疗不能彻底根除这种病毒;它持续存在于免疫细胞内的病毒库中,这种现象称为“潜伏(latency)”。即使一个人在感染后很早就开始治疗,这种潜伏性HIV病毒库仍会形成,但是人们在很大程度上尚不清楚这种病毒库形成的动态变化。
如今,在一项新的研究中,来自美国北卡罗来纳大学教堂山分校、哥伦比亚大学、天普大学和南非开普敦大学、夸祖鲁纳塔尔大学的研究人员发现有证据表明最初使用ART会改变宿主环境,这使得大多数长期存在的HIV病毒库形成或变得稳定,并且它们此后还能够存在很多年。相关研究结果发表在2019年10月9日的Science Translational Medicine期刊上,论文标题为“The replication-competent HIV-1 latent reservoir is primarily established near the time of therapy initiation”。
HIV-1病毒,图片来自 J Roberto Trujillo/Wikipedia。
他们的研究表明血液中长期存在的HIV病毒库主要反映了开始治疗时存在的HIV毒株,这些潜伏性病毒在治疗数年后仍持续存在。这意味着这种治疗本身间接地导致了大多数潜伏性HIV病毒库的形成,或者这种病毒库群体在治疗前是不稳定的,但在治疗开始时变得稳定。
论文共同通讯作者、北卡罗来纳大学教堂山分校医学院生物化学与生物物理学教授Ronald Swanstrom博士说,“这真是个大惊喜。我们的研究表明如果我们能够更好地理解HIV病毒库形成过程,那么我们就可能能够在治疗开始时进行干预,以便减少这时形成的大部分病毒库。”
4.Lancet HIV:注射激素能够缓解HIV携带者的肝病恶化
doi:10.1016/S2352-3018(19)30338-8
近日,来自波士顿麻省总医院(MGH)以及NIH研究人员报告说,注射激素“替沙莫林”可以减少HIV感染者的肝脏脂肪并防止肝纤维化(疤痕形成)。研究结果在线发表在《The Lancet HIV》杂志上。
非酒精性脂肪性肝病(NAFLD)经常与HIV共同存在,在发达国家中,25%的HIV感染者同时患有非酒精性脂肪肝,这是肝脏恶化和肝癌发生的危险因素。然而,目前尚无有效的治疗方法来治疗该疾病,。 NIAID免疫调节实验室高级研究医师Colleen M. Hadigan博士和MGH代谢部主任Steven K. Grinspoon博士领导的这一项目测试了替沙莫林是否可以减少HIV携带者的肝脏脂肪和NAFLD的发生。在参加测试的志愿者中,有43%至少患有轻度纤维化,而33%符合非酒精性脂肪性肝炎(NASH)的更严重的NAFLD的诊断标准。 参与者被随机分配为两组,其中31名参与者每天接受2 mg的替沙莫林注射,而另外30名参与者接受注射外观相同的安慰剂。之后,研究人员比较了两组患者在基线和12个月治疗之后的肝脏健康状况。
结果表明,接受替沙莫林治疗的参与者的肝脏健康要比接受安慰剂的参与者好。接受“替沙莫林”治疗的患者中有35%“HFF”值达到了正常水平,而仅接受安慰剂的患者中只有4%达到了这一范围。总体而言,替沙莫林具有良好的耐受性,并且可将参与者的HFF值降低4.1%(相对降低37%)。此外,与安慰剂相比,服用替沙莫林的患者体内与炎症和肝损伤相关的几种血液标志物的水平(包括丙氨酸转氨酶(ALT))的下降幅度更大。
5.Science子刊:揭示艾滋病毒无法治愈的重要原因!
doi:10.1126/sciadv.aav2045
联合抗逆转录病毒治疗(antiretroviral therapy,cART)期间艾滋病毒的持久性是治愈的主要障碍。然而目前研究人员对导致艾滋病毒持久性的机制仍然不确定;感染可通过感染细胞的持续性和克隆扩增或在抗逆转录病毒穿透性差的解剖位置进行持续复制来维持。这些机制需要不同的根除战略,因此确定它们对艾滋病毒持久性的贡献至关重要。
近日一项发表在《Science Advances》上的研究中,来自美国NIH、意大利米兰大学和英国伦敦大学学院的研究人员领导的一项研究使用系统发育的方法在DNA水平上调查了在结肠镜检查或尸体解剖中获得的8至16年的受试者血液、淋巴和其他受感染组织中的艾滋病毒人群。研究人员没有发现艾滋病毒持续复制或区域化的证据;但是他们确实检测到了cART之前感染细胞的克隆扩增。
因此,研究人员认为长期的坚持,而不是持续的复制,是维持艾滋病毒的主要原因。因此,启动cART时出现的艾滋病毒感染细胞是唯一可识别的持久性来源,也是根除艾滋病毒的重点关注对象。
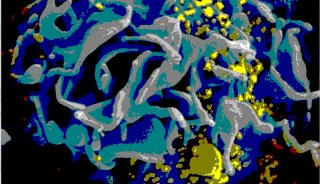
6.Science子刊:高分辨率地可视化观察HIV病毒在体内如何增殖
doi:10.1126/sciadv.aaw8651
为了治疗疾病,人们必须了解它是如何产生的。在一项新的研究中,来自德国、英国、法国、西班牙和澳大利亚的研究人员如今利用高分辨成像技术在毫秒分辨率下可视化观察HIV病毒如何在活细胞之间扩散。通过使用超高分辨率STED荧光显微镜,他们首次提供了直接证据表明自艾滋病病原体(即HIV病毒)为它的自身复制构建出某种脂质环境。针对此,他们创建了一种方法来研究这种病毒复制如何可能被潜在地阻止。相关研究结果发表在2019年10月2日的Science Advances期刊上,论文标题为“HIV-1 Gag specifically restricts PI(4,5)P2 and cholesterol mobility in living cells creating a nanodomain platform for virus assembly”。论文通讯作者为德国耶拿大学的Christian Eggeling教授和法国蒙彼利埃传染病研究所的Delphine Muriaux。
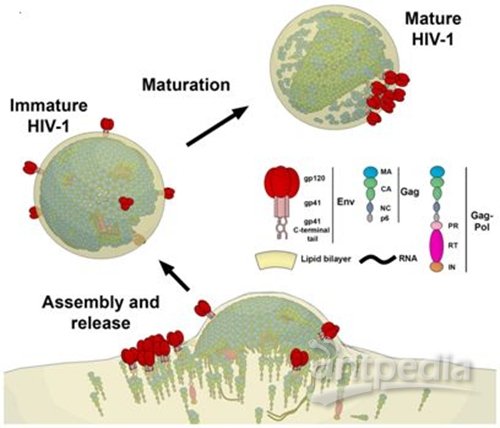
图片来自Science Advances, 2019, doi:10.1126/sciadv.aaw8651。
Eggeling说:“这为我们提供了一种用于开发抗病毒药物的潜在靶标。了解哪些分子是HIV病毒从宿主细胞中释放出来并进行复制所需的是研究如何预防这种病毒感染的关键先决条件。借助我们的技术,我们如今可以直接追踪这一点。”Eggeling和他的团队如今想要开发攻击这些分子的抗体,从而抑制HIV病毒的传播。
7.Oncotarget:揭示外泌体HIV-1 Tat对人细胞蛋白表达的影响
doi:10.18632/oncotarget.27207
HIV-1表达的Tat蛋白是一种强效的病毒转录激活剂。之前的研究已证实在从长期接受抗逆转录病毒治疗的患者体内分离出的原代CD4+ T细胞中,外泌体中的Tat能够逆转HIV-1潜伏性,这表明Tat作为一种治疗性的HIV-1潜伏逆转试剂(HIV-1 Latency Reversal Agent)发挥着潜在的作用。
在一项新的研究中,来自美国布朗大学的研究人员发现HIV-1 Tat表达干扰了细胞蛋白表达。相关研究结果近期发表在Oncotarget期刊上,论文标题为“Impact of exosomal HIV-1 Tat expression on the human cellular proteome”。论文通讯作者为Nagib Ahsan博士和Bharat Ramratnam博士。
通过使用猿猴免疫缺损病毒(SIV)模型,这些研究人员发现不受控制的病毒复制会导致HIV-1 Tat介导的FOXO3激活,这接着导致诸如Bcl-2之类的抗凋亡基因下调和促凋亡基因Bcl-2-like 11上调。
8.JCI:临床试验表明在人体接种HIV疫苗6周内就会出现HIV抗体反应
doi:10.1172/JCI128699
在美国开展的一项早期阶段的临床研究中,对4个随机治疗组(T1、T2、T3和T4)分别给予不同的DNA(DNA-HIV-PT123)和蛋白(AIDSVAX B/E)疫苗组合,以确定哪种疫苗组合会诱导有利的HIV特异性抗体和T细胞反应。在美国埃默里大学艾滋病研究中心的Nadine Rouphael博士和罗彻斯特大学医学中心的Michael Keefer博士的领导下,这项新的研究证实DNA (DNA-HIV-PT123)和蛋白(AIDSVAX B/E)疫苗组合方案诱导出高强度的持久的结合抗体反应,而且当联合给予这种疫苗组合方案(即同时给予DNA疫苗和蛋白疫苗)时,可观察到更快速的潜在保护性免疫反应产生。相关研究结果近期发表在Journal of Clinical Investigation期刊上,论文标题为“DNA priming and gp120 boosting induces HIV-specific antibodies in a randomized clinical trial”。
这项称为HVTN 105的临床研究由位于弗雷德-哈钦森癌症研究中心的HIV疫苗试验网络(HIV Vaccine Trials Network, HVTN)开展,并且得到美国国家卫生研究院(NIH)下属的国家过敏与传染病研究所(NIAID)的资助。
HVTN 105临床研究招募了140名具有较低HIV感染风险的参与者。这些研究参与者被随机分配到这四个治疗组之一,并且第0、1、3和6个月时接受肌肉注射。在所有治疗组中,所有疫苗接种方案都是安全且耐受性良好的。有趣的是,对在T3和T4治疗组中观察到的疫苗诱导的免疫反应进行比较。T3治疗组中的研究参与者被给予一种改良的RV144疫苗方案,具体而言就是在RV144中使用的ALVAC载体在第0和1个月被DNA疫苗替代,然后在第3和6个月同时接种DNA疫苗和蛋白疫苗。T4治疗组中的研究参与者在这四个疫苗接种时间点(第0、1、3和6个月)均同时接种了DNA疫苗和蛋白疫苗。
鉴于RV144疫苗方案的部分功效似乎归功于几种已确定的保护相关因素,因此在这项新的研究中,这些研究人员研究了HVTN 105疫苗方案是否诱发了相同的反应。与RV144相类似的是,T3和T4治疗组中给予的疫苗组合方案在95%~100%的研究参与者中诱导出与gp120(HIV Env)和Env的V1V2区域相结合的抗体。在HVTN 105的所有治疗组中均可检测到T细胞反应。T3和T4治疗组均显示出较高的抗体依赖性细胞毒性(ADCC)和中和抗体反应。T4治疗组中的疫苗接种方案诱导出比T3治疗组中更低的IgA/IgG比值,这种表明这种疫苗接种方案是对RV144方案的改进,这是因为这表明这种风险相关因素降低了。 T4治疗组中的疫苗接种方案的另一个令人吃惊的发现是高水平的IgG4反应,这在HIV感染的情况下的重要性尚不明确。
9.Org Biomol Chem:水溶性富勒烯衍生物有效抵抗流感病毒、HIV、HSV和CMV等多种病毒
doi:10.1039/C9OB00593E
在一项新的研究中,俄罗斯研究人员发现一种新方法有助于获得水溶性的富勒烯衍生物(fullerene derivative),所获得的富勒烯衍生物有效地抵抗流感病毒、人类免疫缺陷病毒(HIV)、单纯疱疹病毒(HSV)和巨细胞病毒(CMV)。相关研究近期发表在Organic & Biomolecular Chemistry期刊上,论文标题为“Diversion of the Arbuzov reaction: alkylation of C–Cl instead of phosphonic ester formation on the fullerene cage”。论文通讯作者为Pavel A. Troshin教授。
论文第一作者Olga Kraevaya解释道,“我们的最新研究的重点在于利用富勒烯衍生物作为一种多功能平台,合成针对危险的病毒感染---比如HIV、不同的流感病毒毒株、HSV和CMV---的高效抑制剂。我们发现了一种独特的逆向阿尔布佐夫反应(inversed Arbuzov reaction),从而允许对新型化合物的抗病毒特性进行微调,并在化合物的结构和抗病毒活性之间建立起基本的关联性。
10.mBio:三十年来鉴定出杀死潜伏性HIV的分子开关
doi:10.1128/mBio.02016-19
在一项新的研究中,来自美国加州大学圣地亚哥分校医学院的研究人员通过使用基因测序,鉴定出一种控制免疫细胞中HIV增殖的关键细胞因子。关闭或剔除这种细胞因子就可清除休眠的HIV病毒库。相关研究结果于2019年9月24日在线发表在mBio期刊上,论文标题为“The Long Noncoding RNA HEAL Regulates HIV-1 Replication through Epigenetic Regulation of the HIV-1 Promoter”。
论文通讯作者、加州大学圣地亚哥分校医学院儿科和遗传学教授Tariq Rana博士说,“这是HIV领域30年来一直在寻找的关键开关之一。这项发现最令人兴奋的部分之前从未观察到。通过对一种长链非编码RNA(lncRNA)进行基因修饰,我们阻止抗逆转录病毒治疗停止后HIV在T细胞和小神经胶质细胞中的反弹,这表明我们具有根除HIV和获得性免疫缺陷综合征(AIDS,俗称艾滋病)的潜在治疗靶标。”
在这项新的研究中,Rana及其同事们报道了对受到HIV感染的巨噬细胞中的lncRNA的首次全基因组表达分析,其中巨噬细胞是促进组织炎症、刺激免疫系统和清除体内外来异物的特定免疫细胞。一般而言,lncRNA并不像其他的RNA一样编码蛋白,相反,它们有助于控制细胞中的哪些基因“开启”或“关闭”。
Rana及其团队描述了一种称为HIV-1增强型LncRNA(HIV-1 EnchancedLncRNA, HEAL)的lncRNA。HEAL似乎是一个近期出现的基因,可调节HIV在免疫细胞(比如巨噬细胞、小神经胶质细胞和T细胞)中的复制。通过联合使用基因组、生化和细胞方法,他们发现当停止ART治疗时,利用CRISPR-Cas9沉默HEAl或者移除它可阻止HIV反弹。还需开展进一步的研究,以便在动物模型中证实这些作用。
-
焦点事件

-
招标采购