BioCryst血浆激肽释放酶抑制剂berotralstat在美国进入审查
BioCryst制药公司致力于发现新型、口服、小分子药物,用于治疗酶在疾病生物学通路起关键作用、存在显著未满足医疗需求的罕见疾病。近日,该公司宣布,美国食品和药物管理局(FDA)已受理berotralstat(BCX7353)的新药申请(NDA),这是一种每日口服一次的药物,用于预防遗传性血管水肿(HAE)攻击。FDA已指定处方药用户收费法(PDUFA)目标日期为2020年12月3日。在NDA受理函中,FDA表示,目前不打算召开顾问委员会会议讨论NDA。
此次提交的NDA,是berotralstat的一种口服胶囊,用于预防HAE发作。berotralstat的另一款口服液体制剂,目前处于II期临床,开发用于治疗急性HAE发作。
berotralstat化学结构(图片来源:probechem.cn)
berotralstat是一种新型、口服、每日一次、强效、选择性人血浆激肽释放酶抑制剂,目前处于后期临床开发,用于预防和治疗遗传性血管水肿(HAE)患者的血管水肿发作。
在III期APeX-2和II期APeX-1临床试验中,berotralstat表现出良好的安全性和耐受性。在III期APxE-2临床试验中,与安慰剂相比,berotralstat(150mg)将HAE发作率显著降低了44%(p<0.001)、并且在50%的患者中将HAE发作率降低≥70%。
目前,BioCryst公司正在开展APeX-S,这是一项长期安全性临床试验。此外,BioCryst公司也完成了ZENITH-1临床试验,这是一项概念验证II期临床试验,评估了berotralstat口服液体制剂治疗急性血管水肿发作。
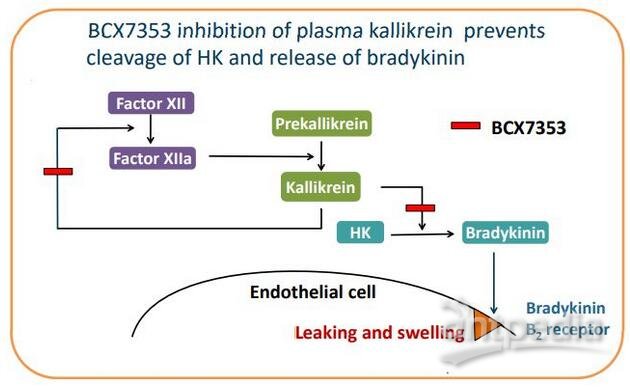
berotralstat作用机制
除了美国FDA之外,BioCryst公司计划在2020年第一季度向日本药品和医疗器械(PMDA)和欧洲药品管理局(EMA)提交berotralstat口服胶囊预防HAE发作的上市申请文件。
BioCryst公司首席执行官Jon Stonehouse表示:“HAE患者群体及其医生们,一直在等待每天一次的口服疗法以防止病情发作。FDA受理我们berotralstat的NDA,并指定今年12月为PDUFA目标日期,意味着患者和医生的等待即将结束。我们将打造一支经验丰富的商业团队,并执行我们的商业计划,准备在berotralstat获得批准后迅速将产品推向美国市场。”
-
仪器推荐
 询底价 Tel:400-6699-117 转 5224
询底价 Tel:400-6699-117 转 5224 -
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐





















