专家点评JCI | 胖子能喝酒?棕色脂肪保护酒精性肝损伤

图片引自:https://www.express.co.uk
中国酒文化源远流长,古人也发出“何以解忧,唯有杜康”的感叹。在中国的礼仪中,有事没事,总要喝点酒,欧阳修诗中也有“酒逢知己千杯少”,但是长期饮酒会导致酒精性肝病,这一点也是被很多研究已经证实。然而在酒文化中,还有一句关于饮酒俗语“小酌怡情,大饮伤身”。如果将饮酒分为适度和过度,那么过度饮酒一定会有害健康,但目前有研究认为适度饮酒有益健康。
2019年3月,在The Journal of Clinical Investigation杂志上,来自于Michigan Medical School的Liangyou Rui教授课题组发表了题目为Brown fat activation mitigates alcohol-induced liver steatosis and injury in mice的论文。研究揭示了一个未被认识的大脑酒精感应/交感神经/BAT/肝脏轴,考虑了棕色脂肪和米色脂肪可以通过燃烧游离脂肪酸和糖原为机体提供代谢益处,作者证实了这些棕色脂肪和米色脂肪是酒精摄入和健康之间缺失的纽带。

长期饮酒会造成肝脏损伤、炎症和纤维化,从而导致发病率和死亡率的增加【1】。然而自相矛盾的是,人们认为适度的饮酒会改善代谢,但其具体机制未知【2】。脂肪组织影响肝脏代谢和稳态。长期饮酒会造成游离脂肪酸增加,而且这些脂肪酸具有脂质毒性,攻击肝脏从而造成肝脏损伤和脂质沉积;同时慢性饮酒不仅直接会造成肝内促炎细胞和介质的释放,也会通过脂肪细胞坏死从而带来全身炎症反应。但是脂肪细胞也有不同的种类和分工,一般人类和啮齿动物具有三种不同类型的脂肪:白色脂肪组织(white adipose tissue,WAT)、棕色脂肪组织(brown adipose tissue, BAT)和米色脂肪。WAT主要作用是将体内多余能量储存,如甘油三酯TAG,并且在空腹状态下释放游离脂肪酸(free fatty acids,FFAs)。BAT和米色脂肪氧化FFAs和葡萄糖产生能量,帮助维持体温。BAT/米色脂肪产热主要是通过Ucp1(棕色脂肪细胞和米色脂肪细胞中特异表达)。Ucp1位于线粒体内膜并且介导质子跨膜,从而将转化成热能【3】。冷暴露可以通过交感神经SNS激活BAT/米色脂肪产热从而抵抗人和啮齿动物的热量损失。重要的是,BAT和米色脂肪可以通过能量消耗抵消体重增加、肥胖和代谢疾病。但是BAT/米色脂肪在酒精性肝病(alcoholic liver disease,ALD)中的作用未知。
Liangyou Rui团队通过体内体外模型揭示了一种新的大脑酒精感应/交感神经/BAT/肝脏轴。打破我们常规对酒精摄入与脂质代谢之间的想法,适度的饮酒也会减慢酒精性肝病过程中脂质沉积的进程。该研究团队通过体内体外模型,并利用多种分子实验学系统的研究了脂肪代谢与酒精之间的关系。
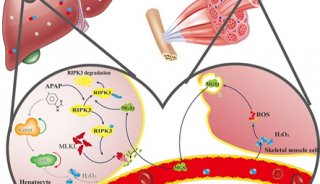
慢性酒精摄入可以显著增加BAT和米色脂肪中Ucp1的表达。虽然周围环境温度影响BAT的活性,但是慢性酒精摄入可以完全预防因为温度上升带来的BAT的白化和活性下降;此外该研究利用酒精直接注射入大脑,切断控制BAT的神经的方法来研究介导酒精激活BAT的途径,发现饮酒或者直接酒精注入大脑会刺激支配BAT的下丘脑神经回路和交感神经,并且通过BAT交感神经依赖方式显著增加BAT解偶联蛋白1(Ucp1)的表达和活化。同时,本文作者通过敲除Ucp1表达,发现会加重雌性和雄性小鼠酒精性脂肪肝变、损伤、纤维化。同时本实验观察到BAT或BAT条件培养基可以直接抑制原代肝细胞死亡,但是去除脂联素和IL6,这种保护作用减弱。说明BAT对酒精性肝病的保护既可以通过释放对肝细胞具有保护作用的脂联素,也可以通过消耗FFAs进行。

总之,本研究发现酒精刺激大脑,可通过交感神经激活BAT,BAT可以消耗FFAs,分泌脂联素,从而预防肝脏脂肪变和肝脏损伤,揭示了一种新型的大脑酒精传感系统/交感神经/BAT/肝脏轴,可以预防酒精性肝脂肪变形、损伤、炎症和纤维化,可以作为ALD的潜在治疗靶点。
专家点评
王华(安徽医科大学肝病研究所教授,国家“优青”)
酒精性肝病发展过程中,肝脏脂肪变性及肝细胞损伤是必经过程,其机制包括上调肝细胞内NADH/NAD+比例,上调肝内SREBP1c表达,抑制PPARα表达【1】等。目前《柳叶刀》上【2】全球疾病负担研究组分析任何程度的饮酒不能带来任何健康收益,推介的酒精摄入量是0!有意思的是,最近美国国立卫生研究院酒精依赖和滥用研究所(NIH/NIAAA) Bin Gao团队发现急性脂肪坏死会造成酒精性肝损伤。该研究表明脂肪细胞坏死不仅会增加CCR2+巨噬细胞浸润和活化,而且通过上调肾上腺素促进脂肪组织裂解,进而进一步加重脂质毒性作用【3】。但是在临床中仍有部分患者在适度饮酒范围内并没有进展成为酒精性肝病,而且有研究表明适度饮酒可以调节胰岛素抵抗以及脂质代谢,说明我们机体存在酒精摄入后保护机体的机制。LiangyouRui团队在研究中向我们展示了一种未被认知的大脑酒精传感系统/交感神经/BAT/肝脏轴,这可以解释我们的对于酒精摄入后未发展成为ALD的疑惑。
研究结果的主要亮点:
首先,通过敲除棕色脂肪/米色脂肪上特异表达的Ucp1基因,证实了Ucp1可能具有减缓酒精性肝病进程,并且与性别无关。同时作者在急性酒精摄入动物模型中也验证了Ucp1的保护作用。接着,作者通过体外实验证实了棕色脂肪除了通过Ucp1抑制脂质向肝脏转运,还可以释放保护肝细胞的脂联素。尤其值得注意的是,作者排除温度对棕色脂肪的影响,证实了酒精可以激活BAT。但是考虑酒精对BAT无直接作用,作者将酒精靶点组织转向了大脑。该研究利用直接酒精注射入大脑,切断控制BAT的神经的方法来研究介导酒精激活BAT的途径,发现饮酒或者直接酒精注入大脑会刺激支配BAT的下丘脑神经回路和交感神经,并且通过BAT交感神经依赖方式显著增加BAT解偶联蛋白1(Ucp1)的表达和活化。
综上所述,作者揭示了一种未被认知的大脑-神经-BAT-肝脏轴,为我们研究酒精与肝脏病变打开了一片崭新的领域,未来我们的研究的观点不仅要关注酒精如何加重肝脏脂质代谢与损伤 ,也可以研究体内不同器官之间的cross-talk对酒精肝的影响,比如脂肪-肝对话,脑-肝对话等等。
参考文献
1. Zhao C, Liu Y, Xiao J, Liu L, Chen S, Mohammadi M, McClain CJ, Li X, and Feng W. FGF21 mediates alcohol-induced adipose tissue lipolysis by activation of systemic release of catecholamine in mice. J Lipid Res. 2015;56(8):1481-91.
2. Holst C, Becker U, Jorgensen ME, Gronbaek M, and Tolstrup JS. Alcohol drinking patterns and risk of diabetes: a cohort study of 70,551 men and women from the general Danish population. Diabetologia. 2017;60(10):1941-50.
3. Kajimura S, Spiegelman BM, and Seale P. Brown and Beige Fat: Physiological Roles beyond Heat Generation. Cell Metab. 2015;22(4):546-59.
4.Seitz, H.K., et al., Alcoholic liver disease. Nat Rev Dis Primers, 2018. 4(1): p. 16.
5.Alcohol use and burden for 195 countries and territories, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet, 2018. 392(10152): p. 1015-1035.
6.Kim, S.J., et al., Adipocyte Death Preferentially Induces Liver Injury and Inflammation Through the Activation of Chemokine (C-C Motif) Receptor 2-Positive Macrophages and Lipolysis. Hepatology, 2019.
-
焦点事件

-
焦点事件

-
科技前沿
-
科技前沿
-
项目成果