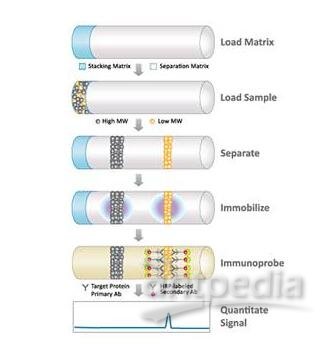
免疫印迹Western bloting实验原理
这种技术是把电泳分离的组分从凝胶转移到一种固相支持体(NC、PVDF膜),并以特异性抗体作为探针检测之。抗体与附着于固相支持体的靶蛋白所呈现的抗原表位发生特异性反应。这种技术的作用是对非放射性标记蛋白组成的复杂混合物中的某些特异蛋白进行定性、分析。
材料(MATERIALS):
o 试剂(REAGENTS)
1.0 M Tris-Hcl(PH6.8)
1.5 M Tris-HCl(PH8.8)
10% AP(不要配太多)
10% SDS
30% Acr
20% Tween20
10 mM PMSF
0.2 M NaH2PO4
0.2 M Na2HPO4
TBST
转移膜
化学发光试剂
转移缓冲液(TB buffer)
电泳缓冲液(EB buffer)
PBS缓冲液
10×丽春红染液
封闭液(5% 脱脂牛奶)
滤纸
SDS 上样缓冲液
实验前准备:
裂解液中加入终浓度为1 mM的PMSF,离心机预冷,PBS预冷,TB buffer 4℃预冷
器械(EQUIPMENT)
垂直板电泳转移装置、高速离心机、分光光度计、脱色摇床、搪瓷盘、蛋白电泳装置、匀浆器
实验步骤(PROCEDURE)
蛋白样品制备 预计时长:1h
(一) 贴壁细胞总蛋白的提取:
按1 ml裂解液加10μl PMSF(100 mM)混匀后置于冰上。
2.吸去细胞培养基,用4℃预冷的PBS洗两次后,根据细胞数目加入相应体积的裂解液摇匀于冰上裂解30 min(60 mm皿加1 ml)期间可摇动混匀。
3.裂解完成后,用枪头将细胞刮掉然后转移到1.5 ml EP管中。
4.2-3步也可为:加入裂解液静置两分钟后刮下细胞,转移到1.5 ml EP管中,用超声破碎细胞。
5.12000 g × 5 min 4℃离心后,转移至新的EP管中。
6.-20℃保存或进行下一步。
(二) 悬浮细胞总蛋白的提取
将培养基倒至15 ml离心管中,800 g × 5 min 4℃离心,吸出培养基,加入2 ml 4℃预冷PBS重悬细胞后再次800 g × 10 min 4℃离心,尽量吸干PBS,加入裂解液冰上裂解30min,裂解过程中要经常弹一弹以使细胞充分裂解。
2.将裂解液与培养瓶中裂解液混在一起12000 g × 5 min 4℃离心,取上清于1.5 ml离心管中并置于-20℃保存或进行下一步。
(三) 组织中总蛋白的提取
将组织块尽量剪碎,加入含PMSF的裂解液于匀浆器中,进行匀浆然后置于冰上。
2.几分钟后,再次匀浆,置于冰上。如此反复几次使组织尽量碾碎。
3. 裂解30 min后,将裂解液移至1.5 ml EP管 中,12000 g × 5 min 4℃离心,取上清于1.5 ml离心管中并置于-20℃保存或进行下一步。
蛋白质定量
一般选择BCA或者Bradford方法,具体方法见各试剂盒说明书。BCA要求检测波长为562 nm,Bradford为595 nm。为避免假阳性结果,建议先把lysis buffer加入BCA工作液或考马斯G250混合看是否产生颜色。具体测完蛋白含量后,计算含50-100 ug蛋白的溶液体积即为上样量(一般8cm宽的迷你胶每个泳道最大能承载的蛋白质量为150ug)。
(一) 制作标准曲线
从-20℃取出1 mg/ml BSA,室温融化后,备用。
2.取18个1.5 ml离心管,3个一组,分别标记为0 μg,2.5 μg,5.0 μg,10.0 μg,20.0 μg,40.0 μg。
3.按下表在各管中加入各种试剂。
| 0 μg | 2.5 μg | 5 μg | 10 μg | 20 μg | 40 μg | |
| 1 mg/ml BSA | 2.5μl | 5μl | 10μl | 20μl | 40μl | |
| 0.15 M NaCl | 100μl | 97.5μl | 95μl | 90μl | 80μl | 60μl |
| G250 溶液 | 1 ml | 1 ml | 1 ml | 1 ml | 1 ml | 1 ml |
4.混匀后,室温放置2 min。在生物分光光度计上比色分析。
(二) 检测样品蛋白含量
取足量的1.5 ml离心管,每管加入4℃储存的考马斯亮蓝溶液1 ml。室温放置30 min后即可用于测蛋白。
2.取一管考马斯亮蓝加0.15 M NaCl 100μl,混匀放置2 min 可作为空白样品,将空白倒入比色皿中做好的标准曲线程序下按Blank测空白样品。
3.弃空白样品,用无水乙醇清洗bisemin2次,用无菌水洗一次。
4.取一管考马斯亮蓝加95 μl 0.15 M NaCl 溶液和5μl 待测蛋白样品,混匀后静置2 min后测量。
SDS-PAGE电泳 预计时长:3.5h
(一)灌胶与上样
玻璃板对齐后放入夹中卡紧。然后垂直卡在架子上准备灌胶(操作前先往玻璃板间灌水,检查是否漏液,然后用滤纸将水吸干)。
2.选择合适的分离胶浓度配置,注意最后加入TEMED,之后摇匀即可灌胶。此外应保证试剂的新鲜,特别是过硫酸铵。灌胶时胶要沿玻璃板流下,否则胶中易有气泡(浓度越小的胶含水越多,凝固后胶体积缩小越多)。然后胶上加一层水或异丙醇,(加水液封时要很慢,否则胶会被冲变形)。注意给浓缩胶留出足够的空间(推荐长度为插入的梳齿长再加1cm)
3.当水和胶之间有一条折射线时说明胶已凝了,一般需半个小时(气温高会快些)。倒去胶上层水或异丙醇并用吸水纸吸干或放倒静置几分钟将水流干。AP不新鲜会导致聚合变慢,必要时可适当增加AP以及TEMED的量,但通常不会超过1h
4.配制浓缩胶,方法与操作同分离胶,将剩余空间灌满浓缩胶然后将梳子插入浓缩胶中,避免胶与梳子之间有气泡。由于胶凝固时体积会收缩减小,从而使加样孔的上样体积减小,所以在浓缩胶凝固前最好在两边补胶至刚刚冒顶。
SDS-PAGE配方
| 分离胶 | 15% | 12% | 10% | 8% | 6% | 浓缩胶 | 5% |
| ddH2O | 1.76ml | 2.64 ml | 3.2 ml | 4.6 ml | 4.24 ml | ddH2O | 3.4 ml |
| 30%丙烯酰胺 | 4ml | 3.2 ml | 2.64 ml | 2.6 ml | 1.6 ml | 30%丙烯酰胺 | 0.83 ml |
| 1.5M Tris-Hcl(8.8) | 2ml | 2 ml | 2 ml | 2.6 ml | 2 ml | 1.0M Tris-Hcl(6.8) | 0.63 ml |
| 10% SDS | 80μL | 80μL | 80μL | 80μL | 80μL | 10%SDS | 50μL |
| 10% APS | 80μL | 80μL | 80μL | 80μL | 80μL | 10%APS | 50μL |
| TEMED | 3.2μL | 3.2μL | 3.2μL | 3.2μL | 3.2μL | TEMED | 5μL |
▲关键步骤:
过硫酸铵用量很少,且易变质,一次不要配太多,最多不超过两周。
2. 未聚合的丙烯酰胺具有神经毒性,操作时应该戴手套防护。
(二)上样、电泳
测完蛋白含量后,计算含50 μg蛋白的溶液体积即为上样量。取出上样样品至1.5 ml离心管中,加入5 × SDS 上样缓冲液至终浓度为1×。(上样总体积一般不超过15 μl,加样孔的最大限度可加20 μl样品。)上样前要将样品100 ℃ 5 min使蛋白变性。
2.浓缩胶电泳电压为110 V,当样品在浓缩胶、分离胶交界处被压为一条线时,电压调为130 V
转膜 预计时长:3h
在电泳结束前20 min开始准备转膜所需的东西。转一张膜需准备6张的滤纸(长一般为8.1~8.3 cm,宽度根据裁的胶大小实际测量,但胶一般会缩水,所以裁8cm就行)和1张NC或PVDF膜。切滤纸和膜时一定要戴干净手套,因为手上的蛋白会污染膜。
PVDF膜使用前用无水甲醇中浸泡1 min-2 min,NC膜不需要。目的是为了活化PVDF膜上面的正电基团,使它更容易跟带负电的蛋白质结合,做小分子的蛋白转移时多加甲醇也是这个目的。
2.将玻璃板撬开后,轻轻刮去浓缩胶,用蒸馏水冲洗干净。取出凝胶后可以在右上角裁一个小角以区分上下左右。之后有两种方法供选择,一是按照marker指示,把含有自己感兴趣的蛋白的胶裁下来,二是把整张胶转膜。
3.在陶瓷盆中倒入TB buffer,放入浸过甲醇的PVDF膜平衡10 min。带上手套,将夹子打开使黑的一面平放转移槽的底座,依次在石墨电极上垫一张海绵垫、叠放3张浸泡过缓冲液的滤纸、刚刚完成电泳的凝胶、PVDF膜(此时可在膜右上角减去一个角,以辨明转膜后的蛋白面与非蛋白面)、和另外3张浸泡过缓冲液的滤纸、另一个海绵垫,合起夹子。注意每叠一层就要用玻璃棒或圆筒试管赶去气泡,膜两边的滤纸不能相互接触,接触后会发生短路。
4.将夹子放入转移槽槽中,要使夹的黑面对槽的黑面,夹的白面对槽的红面。电转移时会产热,所以TB Buffer要在4℃预冷,转移槽要放在冰水混合泡沫箱中。的一边放一块冰来降温。一般用60 V转移2 h或40 V转移3 h。
5.转完后将膜用1× 丽春红染液染5 min(于脱色摇床上摇,可回收)。然后用水冲洗掉没染上的染液就可看到膜上的蛋白。使用预染marker话可以看见marker的颜色转印到了膜上,但是凭借这个颜色来判断是否转印完全或转印过头是不可靠的。
▲关键步骤:操作是要戴手套,否则手上的蛋白会造成污染。
免疫杂交反应 预计时长:1 Day
封闭:将膜用TBST浸湿,移至含有封闭液的平皿中,室温下脱色摇床上摇动封闭1 h即可,注意封闭后不要洗脱,(如果是自己配置的封闭液,最好过滤一下以消除固体杂质)。
2.一抗孵育: 将一抗用封闭液稀释(一般用封闭液稀释即可,如果背景不高用TBST稀释也可以)至适当浓度(可以在5 ml EP管中配置工作液,常用稀释倍数为1:1000,具体按抗体说明来,用后可回收重复用2-3次, -20℃保存,避免反复冻融)。
一、二抗孵育有两种方法:
1) 膜孵:撕下适当大小的一块儿封口膜(也可使用保鲜膜)铺于培养皿盖上,使封口膜保持平整,将抗体溶液加到封口膜上,从封闭液中取出膜,用滤纸吸去残留液后,将膜蛋白面朝下放于抗体液面上,掀动膜四角以赶出残留气泡,放于湿盒中,室温孵育1 h或4℃过夜孵育。用TBST在室温下脱色摇床上洗6×5 min。
2)配制5 ml抗体稀释液于5 ml EP管中,直接将膜放入,4℃过夜孵育,用TBST在室温下脱色摇床上洗4×5 min。
3.二抗孵育: 方法同一抗孵育,但一般二抗稀释比较大1:10000足够。用TBST在室温下脱色摇床上洗4×5min。
化学发光 预计时长 10min
化学发光反应:在实验台上铺一张一次性手套,将转移膜放在手套上,蛋白面向上。将化学发光的A液和B液两种试剂在EP管内等体积混合(总体积能够覆盖住膜就行,注意吸完A液后吸B液要换枪头,否则整瓶试剂都将报废),然后均匀滴在PVDF膜的蛋白面,反应1-2 min后(无需避光),将PVDF膜上多余的ECL工作液吸干,凝胶图象分析或X-光片曝光。
X-光片曝光:
将转移膜放在保鲜膜上,把另一侧翻过来盖在其上,把保鲜膜固定在片夹上。
2.在暗室中,将配好的显影液和定影液倒入塑料盆中,打开红色照明灯,取出X光片,剪成比膜稍大,叠放3-4层后放在膜上,不要再移动X光片,关上X片夹,计时2-5 min。(多层胶片的目的是找到最合适的曝光度)
3.时间完成后,打开片夹,X光片放入显影液,出现明显条带后停止显影,放入定影液,定影5-10 min至胶片透明。
4.用水将胶片冲干净,晾干,观察结果。定影液和显影液可回收,避光室温放存,但不宜放太久。
▲关键步骤:
发光液的A、B液一定不能相互污染,吸取时一定要注意换枪头。
2.发光液配制好后应立即使用。
3.暗室中光线很弱,可暗适应一段时间在开始实验,拿胶片的时候避免用指甲滑到,会有划痕。
附录
相关试剂的配制:
封闭液(5% 脱脂牛奶的TBST缓冲液)
脱脂奶粉 5g
TBST 100ml
溶解后4℃保存。使用时,恢复室温,用量以盖过膜面即可,一次性使用。如不经常用,可每次现用现配所需体积。
2.TBST缓冲液(含0.05% Tween20的TBS缓冲液)
20%Tween20 1.65ml
TBS 700ml
混匀后即可使用,最好现用现配。
3.TBS缓冲液(100 mM Tris-HCl pH 7.5,150 mM NaCl)
1 M Tris-HCl(pH7.5) 10 ml
NaCl 8.8g
蒸馏水至 1000ml
4.10×丽春红染液
丽春红S 2 g
三氯乙酸 30 g
磺基水杨酸 30 g
蒸馏水至 100 ml
使用时将其稀释10倍。
5.转移缓冲液(48 mM Tris,39 mM甘氨酸,0.037% SDS,20% 甲醇)
甘氨酸(MW75.07) 2.9g
Tris(MW121.14) 5.8g
SDS 0.37g
甲醇 200ml
蒸馏水至 1000ml
溶解后室温保存,次溶液可重复使用3~5次
6.电泳液缓冲液(25 mM Tris,0.25 M甘氨酸,0.1% SDS)
Tris(MW121.14) 3.03g
甘氨酸(MW75.07) 18.77g
SDS 1g
蒸馏水至 1000ml
溶解后室温保存,次溶液可重复使用3-5次。
7.1.74 mg/ml (10 mM) PMSF
PMSF 0.174 g
异丙醇 100 ml
溶解后,分装于1.5 ml离心管中,-20℃保存。
8.10% SDS
SDS 10 g
蒸馏水至 100 ml
0℃水浴下溶解,室温保存。
如在长期保存中出现沉淀,水浴溶化后,仍可使用。
9.10% 过硫酸胺(AP)
过硫酸胺 0.1 g
超纯水 1.0 ml
溶解后,4℃保存,保存时间为1周。
10.30% Acr/Bic
丙稀酰胺(Acr) 29 g
甲叉双丙稀酰胺(Bic) 1 g
超纯水至 100 ml
37℃下溶解后,滤膜过滤,棕色瓶4℃保存。使用时恢复至室温且无沉淀。
11.20% Tween20
Tween20 20 ml
蒸馏水至 100 ml
混匀后,4℃保存。
12.0.01 M PBS(PH 7.3)
0.2 M NaH2PO4 19ml
0.2 M Na2HPO4 81ml
NaCl 17g
蒸馏水至 2000 ml
13.G250 考马斯亮蓝溶液(测蛋白含量专用)
G250 100 mg
95% 乙醇 50 ml
磷酸 100 ml
蒸馏水至 1000 ml
先用乙醇溶解考马斯亮蓝染料,再加水和磷酸,混匀后4℃保存。
14.100 mg/ml 牛血清白蛋白(BSA)
BSA 0.1g
0.15 M NaCl 1 ml
溶解后,-20℃保存。制作蛋白标准曲线时,用0.15 M NaCl 进行100倍稀释成1mg/ml,-20℃保存。