武汉大学舒红兵院士发表Nature Immunology新文章
武汉大学的研究人员证实,iRhom2通过介导接头蛋白STING转运和稳定性,对抗DNA病毒天然免疫起至关重要的作用。这一研究发现发布在7月18日的《自然免疫学》(Nature Immunology)杂志上。
武汉大学生命科学学院的舒红兵(Hong-Bing Shu)教授是这篇论文的通讯作者。舒红兵主要从事免疫相关的细胞信号传导研究,在抗病毒天然免疫反应等领域取得了一系列有重要国际影响的成果。2011年当选为中国科学院院士。其课题组的“抗病毒天然免疫信号转导机制”研究项目获得了2015年度的国家科技奖。
天然免疫反应是宿主在病毒入侵后第一时间开启的重要防御措施。宿主细胞受到病毒感染后,细胞内的模式识别受体(PRRs)识别病毒的病原相关分子模式(PAMPs),起始一系列的信号转导事件,诱导I型干扰素、炎症因子和其它一些下游抗病毒蛋白的表达。这些下游的细胞因子和效应物抑制病毒的复制,清除被感染的细胞,促进适应性免疫的发生。
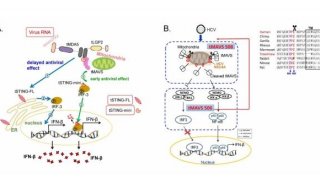
STING (也称MITA、MPYS或ERIS)是病毒诱导I型干扰素表达信号通路中一个非常关键的蛋白,它通过N端的跨膜结构域(TM)将其锚定于内质网、线粒体或线粒体相关膜结构上,通过C端的CTD结构域(CTD)与第二信使cGAMP结合。cGAMP是由DNA受体cGAS识别胞浆中的病毒DNA后,以ATP和GTP为底物合成的环化二核苷酸。cGAMP作为第二信使,在DNA病毒诱导的天然免疫反应中发挥重要作用。病毒感染细胞后,二聚化的STING与cGAMP结合,引起STING构象的改变。活化的STING从内质网经高尔基体迁移到细胞核周围中的点状膜结构上。STING作为支架蛋白,招募TBK1和IRF3,进而促使TBK1磷酸化IRF3,磷酸化的IRF3入核,诱导下游基因的表达。此外,STING还能激活STAT6诱导特异趋化因子产生,吸引各种免疫细胞抵抗病毒感染。
近年来,舒红兵课题组对于STING在天然免疫信号通路中作用的机制取得了较深的认识。2012年,其在JBC杂志发表细胞抗病毒天然免疫机制研究成果,证实E3泛素连接酶TRIM32通过泛素化修饰MITA/STING从而调控了病毒感染诱导的I型干扰素表达及细胞抗病毒反应(武大舒红兵院士JBC发表新成果)。
2014年,舒红兵院士与中科院武汉病毒研究所的王延轶研究员合作证实,内质网(ER)相关蛋白ZDHHC1是DNA病毒触发的、MITA/STING依赖性先天免疫信号的正调控因子。这一研究发现发表在《Cell Host & Microbe 》杂志上(武大舒红兵院士Cell子刊发表最新免疫成果 )。
2016年6月,舒红兵领导武汉大学、中科院武汉病毒研究所的研究人员证实,LSm14A通过以一种细胞特异性方式调控MITA/STING水平,在抗病毒免疫反应中发挥了至关重要的作用。这一研究发现发表在《The Journal of Immunology》杂志上(武汉大学舒红兵院士权威期刊发表免疫新成果 )。
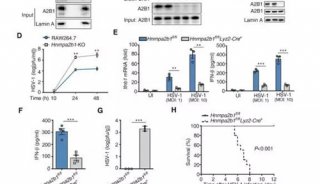
在这篇新文章中,舒红兵与同事们一起确定了iRhom2是DNA病毒触发诱导I型干扰素的一个正调控因子。iRhom2缺陷可显著损害细胞中DNA病毒和胞内DNA诱导的信号传导,iRhom2缺陷小鼠更易受致命1型单纯疱疹病毒(HSV-1)感染。他们证实iRhom2组成性结合STING,在两个不同的过程中发挥作用调控了STING活性。iRhom2招募易位子相关蛋白TRAPβ至STING复合物处,促进了STING从内质网转运至核周微粒体。iRhom2还招募了去泛素化酶EIF3S5通过除去K48连接的聚泛素链维持了STING的稳定性。
这些结果表明了iRhom2对于STING的活性至关重要,它调控了TRAPβ介导的STING易位和EIF3S5介导的STING去泛素化。
-
项目成果
-
科技前沿