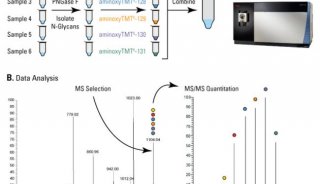
技术推广 DIA+PRM技术,全蛋白筛选及目标蛋白验证一体化
随着质谱仪器的不断更新换代,蛋白组学的技术也不断的革新,从最早的2-D电泳技术到基于LC-MSMS的蛋白定性;从Labelfree 技术到标记定量iTRAQ/TMT技术以及时下备受推崇的DIA/SWATH技术、PRM/MRM技术,每一次的技术革新都使得蛋白组学研究更上一阶。
当下蛋白组学研究中应用最广泛的技术是同位素标记定量(iTRAQ/TMT技术)。 iTRAQ/TMT技术利用的用DDA扫描模式,其扫描的方式是将一级质谱信号最强的Top 20的多肽进行二级打碎,然后进入二级质谱进行检测。其优势是二级谱图采集的肽段信息都来源于同一条多肽,有利于后续的定性分析,但这种采集方式会忽略一些肽段的信息;而且对于大样本量的组学实验,iTRAQ/TMT技术也存在一定的通量限制。那么有没有一种技术可以解决目前蛋白组学困局呢?
对于组学数据的验证,常规的方法有:PCR、RT-PCR、WB技术、Elisa技术等,但是对于蛋白组学的验证,RNA水平的验证显然不能满足科研工作者的要求;WB技术和Elisa技术虽然在某种程度上解决了不同组学之间的尴尬,但是由于抗体的定制难度,在非模式物种中的应用一直无法进行。在这样的一个基础上,DIA、PRM技术隆重登场... DIA+PRM技术可以解决目前蛋白组学中存在的这些问题。
DIA技术原理
DIA技术是先利用常规DDA质谱检测技术分析建立图谱库,之后采用DIA方法进行质谱数据采集,从而实现对样品中蛋白质的定性及定量,不同于传统的DDA技术,DIA技术将质谱整个全扫描范围分为若干个窗口,高速、循环地对每个窗口中的所有离子进行选择、碎裂、检测,因此可以无遗漏地获得样本中所有离子的全部碎片信息,数据利用度大大提高,缺失值更少。因此,DIA技术更适合于大样本量、复杂体系的蛋白检测。
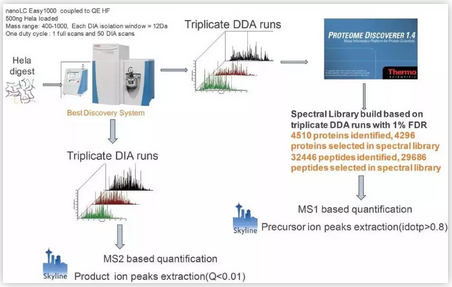
图1 | DIA技术流程
DIA优势
DDA模式对肽段离子的选择具有限制性和随机性,存在较多的数据信息缺失,而DIA模式的目标则是获得完整的数据,实现蛋白质的深度覆盖和精准定量。此外在复杂样品中,二级信号的定量比一级信号更为灵敏(例如一级质谱信号可能存在相似质荷比离子的干扰)。DDA模式为一级质谱信号定量,而DIA模式为二级质谱信号定量,因此DIA模式的定量准确性和重现性都更好。
DDA模式下肽段分子和其二级碎片离子有着对应关系,通过对已知数据库的搜索匹配,即可得到样本中的肽段及相关蛋白质信息。而DIA模式下肽段离子与其碎片离子之间的直接关系丢失(DIA光谱中的碎片离子可能是由多个肽段离子),复杂的谱图仍然给后续的数据分析和统计学检验带来很多挑战。对此目前已有多个团队开发出DIA分析的软件,例如OpenSWATH和Skyline,这些软件通过建立样本的参考库,对色谱峰进行抽提并分析。此外也有研发团队提出不需要参考库的数据分析方法DIA-Umpire,通过对肽段离子和碎片离子的匹配合成产生虚拟谱图进而搜库分析。因此,DIA技术非常适合一次性获取数百上千种蛋白质更为全面信息(高覆盖率,高准确度,高重复性)的研究;而且检测的数据可永久保存,方便后续做回溯性分析。
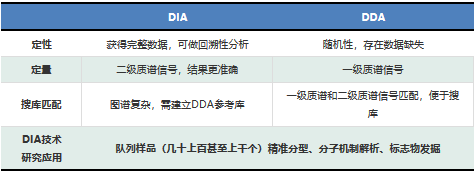
表1. DIA和DDA技术对比
PRM技术原理
PRM:平行反应监测(Parallel Reaction Monitoring) 是一种基于高分辨、高精度质谱的离子监视技术,能够对目标蛋白质、目标肽段(如发生翻译后修饰的肽段)进行选择性检测,从而实现对目标蛋白质/肽段进行绝对定量。PRM技术基于Q-Orbitrap为代表的高分辨、高精度质谱平台(MRM技术基于SCIEX Triple Tof 系列质谱,以SCIEX-5600为代表),首先利用四级杆质量分析器的选择能力,用Q1选择目标肽段的母离子,随后在Collision cell 中对母离子进行碎裂, 最后利用Orbitrap分析器在二级质谱中检测所选择的母离子窗口内的所有碎片信息。这样即可对复杂样本中的目标蛋白质/肽段进行准确地特异性分析。
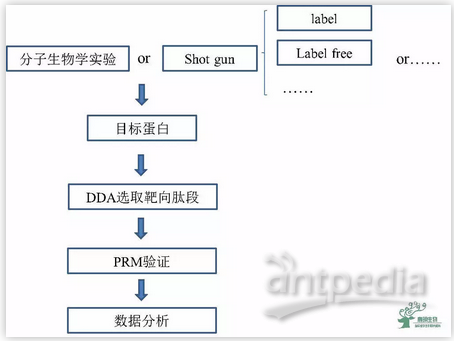
图2 | PRM靶向定量蛋白质组学分析基本流程
PRM优势
PRM作为蛋白质组学靶向质谱检测方法,无需抗体,其通过Q-Orbitrap系列质谱仪,以四极杆作为质量过滤器,特异性地选择与预先设定质荷比相同的肽段离子(母离子)通过,可以有效排除干扰离子,有着高度特异性。其基于二级碎片离子定量,定量准确度高。与传统MRM技术相比,更高分辨、更高质量精度的Orbitrap分析器使得其有着更高的灵敏度,且其对二级离子全扫描,无需预设子离子,方法学建立简便,结果更为准确。以DDA结果建立的PRM参考库,使得PRM不仅具有靶向定量分析能力,同时还具备定性能力。在确保数据质量的前提下,为了在一次分析中检测更多的蛋白质,可用预置PRM(Scheduled PRM, sPRM)的方法,这种方法需要知道每个肽段的保留时间信息,使得每个肽段只在其洗脱时间窗口内执行PRM检测,大大提高了检测效率,通量高,可同时检测几十种蛋白质。其技术优势使得PRM技术可区分高度相似蛋白,包括验证蛋白质翻译后修饰、突变、蛋白亚型等序列高度相似蛋白。
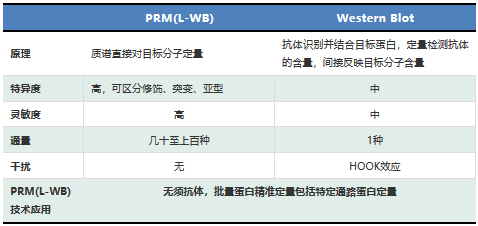
表2. PRM技术优势
PRM和DIA各自都有这么多优势,那将这2个前沿的技术合起来使用会是什么样的效果呢?显而易见,合起来使用,你不仅可以享受到给各自的优势,还具备PRM验证可使用DIA的数据库资源,也就是说不用重复建库,一个数据库就搞定(PS:省了一笔重复建库费用);另外,PRM验证让您不再忧愁各种途径找定制化抗体。
那么DIA+PRM技术能够适用哪些研究呢?答案是各领域均适用,尤其是针对临床医学样本,更是强力推荐。
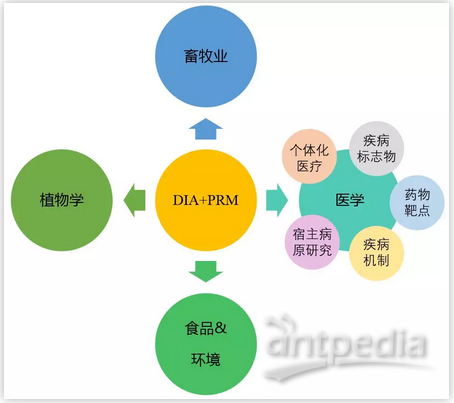
图3 DIA+PRM技术适用于各个研究领域
下面让我们一起来看一个DIA+PRM的文献实例(J Proteome Res. 2018 Jan 5;17(1):76-85.)

蛋白质组学DIA+PRM技术研究研究Pro-B淋巴细胞Ebf1杂合性
Early B cell factor 1(EBF1)是协调B细胞谱系发育所需的关键转录因子之一。尽管研究表明Ebf1单倍剂量不足(haploinsufficiency)参与白血病的发展,但尚未表征Ebf1杂合性对pro-B淋巴细胞蛋白质组的全局影响。来自德国弗莱堡马克斯普朗克免疫生物学和表观遗传学研究所Gerhard Mittler团队,通过DDA(data dependent acquisition)和DIA(data independent acquisition)质谱技术鉴定Ebf1+/+ and Ebf1+/-细胞系间的差异表达蛋白,发现DIA鉴定结果无论是蛋白鉴定数目还是得到的差异蛋白数目,均要优于DDA鉴定结果。
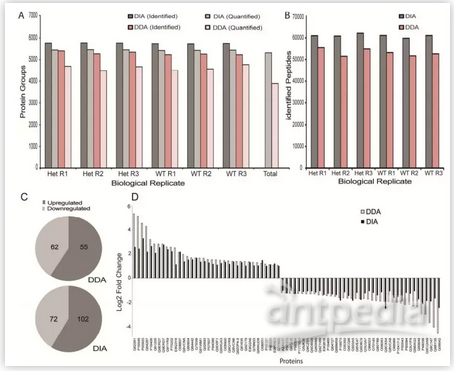
图4. 比较DDA和DIA方法鉴定到的肽段、蛋白质和差异蛋白数量
接着该团队选择了5种差异蛋白(EBF1, Pax5, TCF3, BCL2 and TNPO3)进行PRM(Parallel Reaction Monitoring)验证,验证结果与DIA结果相吻合。结果表明与EBF1相似,其他B细胞谱系调节因子(例如TCF3和Pax5)的表达也在Ebf1杂合细胞中下调。此外DIA差异表达蛋白的功能性分析显示,EBF1杂合性导致至少八种参与淋巴细胞生成的转录因子的失调,并且导致在pro-B淋巴细胞的存活、发育和分化中起作用的关键蛋白的失调。
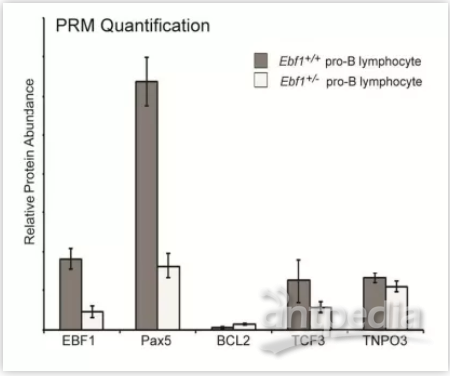
图5. 候选蛋白的PRM相对定量验证结果
参考文献
Musa YR et al. Comprehensive Proteomic Investigation of Ebf1 Heterozygosity in Pro-B Lymphocytes Utilizing Data Independent Acquisition. J Proteome Res. 2018 Jan 5;17(1):76-85.