Nature重磅:母亲孕期缺乏维C竟会导致这些严重后果
在人体内,维生素C是高效抗氧化剂,用来减轻抗坏血酸过氧化物酶的氧化应激。还会参与有许多重要生物合成过程。
大多数哺乳动物都能靠肝脏来合成维生素C,所以并不存在缺乏的问题。
然而,人类、灵长类动物、土拨鼠等少数动物却不能自身合成维生素C,因此,人类必须通过食物、药物等获取维生素C。
由于蔬菜和水果中含有丰富的维生素C,因此缺乏维生素C的情况并不多见。但是,孕妇、婴幼儿、老年人仍有不少缺少维生素C的情况发生。
发育通常被认为是由基因决定的,是基因组中固有的,但有一些证据表明,包括在哺乳动物中,发育容易受到环境调节的影响,并可能产生长期后果。
胚胎种系由于具有代际表观遗传效应的潜力而受到特别关注。哺乳动物的胚系经历了广泛的DNA去甲基化,DNA去甲基化很大程度上是由连续的细胞分裂过程中被动的甲基化稀释造成的,同时也随着TET酶的DNA主动去甲基化。
TET酶(ten-eleven translocation)是生物体内存在的一种α-酮戊二酸(α-KG)和Fe2+依赖的双加氧酶,可以催化5-甲基胞嘧啶(5-mC)转化为5-羟甲基胞嘧啶(5-hmC),是DNA去甲基化过程中的一种重要的酶。TET酶的活性受营养素和代谢产物的调节, 如维生素C。
近日,加州大学、多伦多大学、伦敦帝国理工学院的研究人员合作,在国际顶尖学术期刊 Nature 杂志发表了题为:Maternal vitamin C regulates reprogramming of DNA methylation and germline development 的论文。
该研究表明,在小鼠模型中,母体孕期补充维生素C对于适当的DNA去甲基化和雌性胎儿生殖细胞的发育是必需的。母体孕期缺乏维生素C并不影响胚胎发育,但会导致雌性后代成年后生殖细胞数量减少、减数分裂延迟和繁殖力下降。
缺乏维生素C的胚胎的生殖细胞转录组与携带Tet1基因无效突变的胚胎的转录组非常相似。维生素C缺乏会导致异常的DNA甲基化,包括减数分裂和转座因子的关键调控因子的不完全去甲基化。
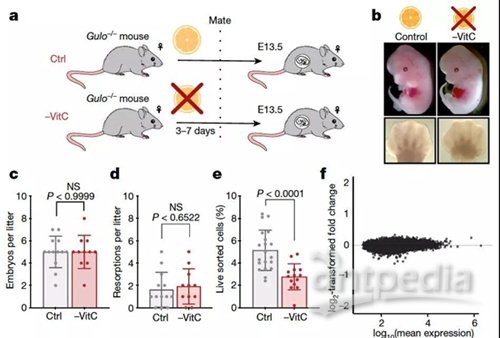
首先,研究人员试图确定维生素C(也称为抗坏血酸)在发育中的胚系中的作用,此时胚系表达高水平的维生素C转运体。他们使用Gulo-/-,Oct4-eGFP小鼠(Oct4也称为Pou5f1)来测试维生素C在生殖系发育中的作用。雌性小鼠在交配前至胚胎期第13.5天(E13.5)期间的饮用水中去除了维生素C。研究人员之所以选择胚胎期第13.5天,是因为此时代表了在生殖系重编程过程中整体DNA甲基化的最低点。他们关注雌性生殖细胞是因为这些细胞在E13.5时进入减数分裂期,而在雄性细胞中减数分裂期只发生在出生后。
研究人员将缺乏维生素C的母鼠的雌性后代与基因相同的对照组小鼠(饮用水含正常水平的维生素C)进行比较,该模型中维生素C的缺乏并不影响胚胎发育,然而,与对照组相比,缺乏维生素C的雌性胚胎中原始生殖细胞(PGCs)的数量显著减少。
当维生素C添加到培养的胚胎干细胞(ES)中,可以诱导DNA去甲基化,并以TET1/ TET2依赖的方式表达一组关键胚系基因,这些基因在体内原始生殖细胞中的表达也依赖于TET1。
值得注意的是,他们发现,在缺乏维生素C的条件下发育的雌性原始生殖细胞中,这些相同的胚系基因一直处于下调状态。
通过RNA测序(RNA-seq)、逆转录定量PCR (qRT-PCR)和免疫组化检测,维生素C缺乏症对胎儿性腺发育进程无整体影响,但会导致生殖细胞数量减少和依赖于TET1的胚系调节基因表达缺陷。
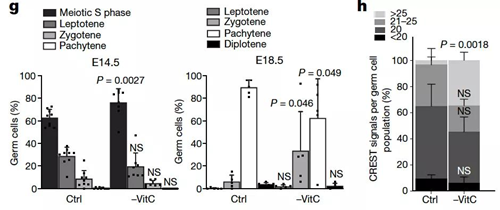
在体内被鉴定为维生素C应答的几个胚系基因是减数分裂起始和发展的重要调控因子。该研究证实,在缺乏维生素C的生殖细胞中,STRA8和SYCP3在RNA和蛋白质水平上显著降低。与对照组相比,缺维生素C的E14.5小鼠卵巢减数分裂S期的生殖细胞比例显著增加。虽然S期后各个阶段的变化并不显著,但在缺乏维生素C的卵巢中,它们的总比例有所降低,这种减数分裂进程的延迟持续到E18.5。
在小鼠生殖细胞减数分裂过程中染色体的成功配对导致每个细胞约有20个着丝点; 然而,缺乏维生素C的胚胎生殖细胞显著增加,每个细胞有超过25个中心体焦点。值得注意的是,直到青春期才发生减数分裂的胎儿睾丸,在缺乏维生素C后,生殖细胞数量、形态或标记蛋白表达均无明显缺陷。
总之,这些数据表明,母体孕期缺乏维生素C会导致雌性胎儿生殖细胞减数分裂的起始和发展出现相当大的缺陷。
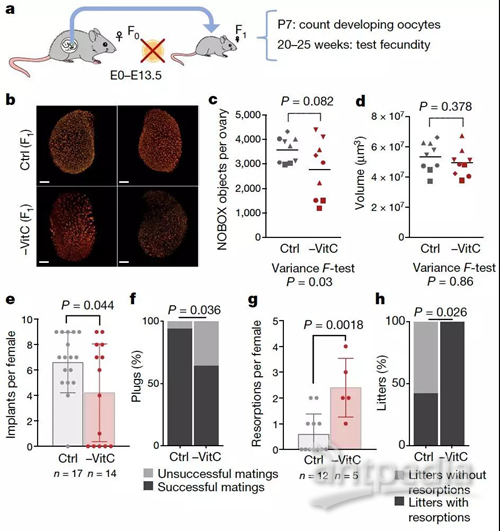
接下来,研究人员研究了妊娠期维生素C缺乏对卵巢储备和生育力的潜在产后影响。怀孕的雌性老鼠(F0)和以前一样缺乏维生素C,从E13.5开始恢复含有维生素C的饮食,并准备生育。研究人员发现,与对照组P7幼鼠相比,这些出生后第7天(P7)的幼鼠子宫内缺乏维生素C,卵巢储备异常变化,一些幼鼠的卵细胞发育非常少,但卵巢体积或卵母细胞大小的总体分布无明显变化。此外,与对照组相比,缺乏维生素C的F1代雌性小鼠每次交配后植入胚胎的数量显著减少,妊娠完全失败(缺乏植入位点)的发生率很高。即使在维生素C缺乏的F1雌性小鼠成功怀孕期间,胚胎吸回的频率也异常高。因此,尽管维生素C缺乏的F1代雌性小鼠可以生育,但它们的繁殖力显著降低。
研究结果表明,在E13.5时补充维生素C到母体饮食中并不能消除妊娠早期维生素C缺乏引起的生殖系功能缺陷。因此,研究人员对E13.5生殖细胞的转录组进行了表征。缺乏维生素C的生殖细胞在转录上与对照细胞是完全不同的。他们共鉴定出412个基因在妊娠期维生素C缺乏后生殖细胞中有差异表达,其中下调基因占多数(下调基因314个,上调基因98个); 值得注意的是,在维生素C缺乏的生殖细胞中下调的一组基因在减数分裂和有性生殖中功能富集。在维生素c缺乏的生殖细胞中,减数分裂的几个关键调控因子位于下调幅度最大的几个基因中。
与缺乏维生素C的胚胎类似,Tet1 -/-雌性胚胎正常存活,但生殖细胞数量减少、减数分裂调节因子表达减少、减数分裂缺陷和生育力下降。但维生素C缺乏并不影响TET、DNMT或其他潜在的维生素C敏感酶在原始生殖细胞中的表达。
这些数据表明,尽管维生素C和TET1可能在雌性胎儿生殖系中具有独特的功能,但维生素C是执行TET1精细介导的转录程序所必需的,并且对正常生育至关重要。
接下来,研究人员使用简并代表性亚硫酸氢盐测序(RRBS)分析比较全基因组范围内,维生素C缺乏与对照组E13.5生殖细胞的基因组DNA甲基化谱。如前所述,E13.5雌性生殖细胞在整体范围内去甲基化,维生素C的存在或缺失并不影响修饰后的胞嘧啶残基在整体范围内的丰度。这些结果与胚系中DNA去甲基化主要通过被动稀释发生的观点相一致,TET1起次要作用。该研究在整个基因组中鉴定了460个差异甲基化区域(DMR)。三分之二的DMR在维生素C缺乏后获得甲基化(285个高甲基化的DMR与175个低甲基化的DMR),这表明维生素C主要用于DNA去甲基化。
值得注意的是,维生素C缺乏引起的高甲基化DMR与卵巢发育异常和雌性不孕相关的序列密切相关。大多数DMR位于转录起始位点(TSSs)的远端。维生素C缺乏后,55个TSSs基因在其5 kb范围内发生高甲基化,这些基因在胚系调节基因中富集。
总的来说,减数分裂中的错误是人类生殖失败的主要原因。值得注意的是,TET酶可与细胞的代谢状态紧密联系。研究人员认为,在胚系发育过程中,TET1与代谢和母体营养的相互联系,可根据环境中关键营养物质的丰富程度来调整生殖所需资源的分配。大多数动物都能自己合成维生素C,但包括人类在内的某些脊椎动物已经丧失了这种能力。此外,环境污染引起的氧化应激可导致维生素C的氧化。考虑到TET1和维生素C对代谢和环境的敏感性,确定气候变化和环境污染对生殖的表观遗传影响将是非常重要的。