RAS靶点的药物的研发进程的梳理盘点
RAS是肿瘤患者中最常见的致癌基因之一,目前包括KRAS、NRAS以及HRAS三种亚型。其中,NRAS突变多见于黑色素瘤和急性骨髓性白血病,HRAS突变多见于膀胱癌和头颈癌,而KRAS突变比其他两种更常见,最常发生在肺癌、胰腺癌以及结直肠癌中,也成为了科学家们着力攻克的热点。RAS曾被医学界称为“不可成药靶点”,科学家们在研究有效的RAS抑制剂方面已经摸索尝试了超过30年,直至近几年才获得了重大突破。
近日,Nature 子刊以题目为RAS-targeted therapies的海报形式发布了关于RAS 靶向疗法的关键性进展,对针对RAS靶点的药物研发进程进行了梳理与盘点。
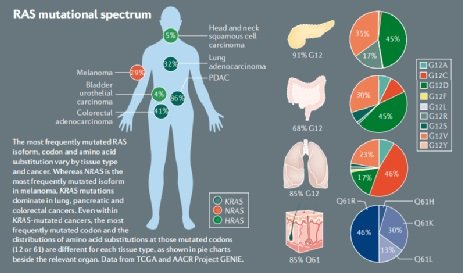
RAS基因突变综述
目前,RAS抑制剂已开辟出多种疗法,通过直接或者间接方式防止RAS突变。本文将根据Nature的回顾梳理进行详细盘点。
一、直接靶向疗法
近年来,以KRAS G12C 抑制剂为代表的直接靶向RAS疗法取得了重大进展。KRAS基因突变主要集中在第12,13及61号密码子处,其中,第12号密码子的突变占到80%以上,包括 G12A、G12C、G12D、G12R、G12S 及 G12V,而KRAS G12C突变占所有KRAS突变的 12%,并在非小细胞肺癌(NSCLC)中占主导地位。
KRAS G12C 抑制剂能共价结合带G12C突变的KRAS,将KRAS G12C 突变体锁死在失活状态。这一疗法首先在Amgen 的 AMG 510 抑制剂上获得了重大突破,AMG 510 主要针对NSCLC,已经在2020年底被FDA授予突破性疗法认定,且获得了优先审评和加速批准的资格,现已进入III期临床试验。同样在这一领域有所突破的是 Mirati,其抑制剂 MRTX849 可以通过与处于失活状态的KRAS G12C突变体的不可逆结合,将它们“锁死”在失活状态,从而抑制KRAS的信号通路。MRTX849 在 I/II期临床试验中都展现了可喜的抗癌活性,已进入III期临床试验阶段。
二、间接靶向疗法
RAS基因与GTP或GDP的结合能力都非常强,但是,当受体酪氨酸激酶被激活时,RAS会从与GDP结合的失活状态转换为与GTP结合的激活状态,从而不断激活RAF、MEK及ERK等下游信号通路靶点,使得细胞不断增殖、分化、形成肿瘤。因此,间接靶向疗法通常是通过抑制其信号通路中的靶点来防止RAS与GTP结合的激活状态,本文将介绍几类热门疗法。
1.EGFR抑制剂
RAS基因位于EGFR的下游通路,它的激活会使得EGFR信号通路活化,在这一过程中,受体酪氨酸激酶将扮演关键角色——促进肿瘤细胞的增殖、肿瘤血管的生成与转移。因此,EGFR抑制剂将通过抑制EGFR受体酪氨酸激酶的活化,阻断其下游信号的转导,从而减少RAS的突变激活。
2.靶向阻断RAS活化
以KRAS为例,KRAS在失活与激活状态之间的转换受到两类因子的调节。一类是GTP酶激活蛋白(GAP),它会促进与KRAS结合的GTP水解成为GDP,从而抑制KRAS的活性,让KRAS处于失活状态;另一类则是鸟嘌呤核苷酸交换因子(GEF),包括SOS蛋白以及SHP2蛋白,这类蛋白会催化KRAS与GTP的结合,从而促进KRAS突变的激活。因此,靶向阻断RAS活化的GEF抑制剂成为了抑制KRAS突变的重点。目前,抑制GEF主要是研发SOS抑制剂以及SHP2抑制剂。
● SOS抑制剂主要通过干扰RAS-SOS1的相互作用以阻断RAS活化。勃林格殷格翰研发管线中的BI-1701963则为SOS1抑制剂,它通过与SOS1的催化区域结合,阻断SOS1驱动的反馈,减少KRAS激活状态的形成。这一抑制剂的优点在于通过选择性地抑制SOS1,可以不考虑KRAS突变类型,能够阻断多种KRAS突变体的活性。
● SHP2抑制剂同样备受关注,SHP2是一种蛋白酪氨酸磷酸酶,参与多种致癌细胞信号级联反应,它可以直接使RAS脱磷酸化,从而增强其与效应蛋白RAF的结合,激活下游MEK/ERK信号通路。靶向抑制SHP2既可减缓癌细胞生长,同时也调节免疫功能以激活其抗肿瘤作用。诺华的TNO-155、加科思与艾伯维联合研发的JAB-3068以及赛诺菲与Revolution联合研发的RMC-4630均押注SHP2抑制剂赛道,且已经进入 I期临床试验。
3.抑制下游信号通路
失活的RAS被激活后,可以激活多条下游信号通路,其中包括MAPK信号通路、PI3K信号通路以及Ral-GEFs信号通路等,这些信号通路在加速肿瘤细胞生存、增殖等方面的作用不可小觑。同时,因为直接靶向RAS的抑制剂研发设计难度较大,使得科学家们将目光对准其下游的信号通路,目前研究最集中的是MAPK通路(RAF-MEK-ERK)和PI3K通路(p110-AKT-mTOR)。
MAPK通路中,RAF、MEK和ERK蛋白中的任何一个因子功能异常,都会导致严重的肿瘤疾病。RAF激酶包括ARAF、BRAF和CRAF,其中,BRAF作为RAF-MEK-ERK信号转导通路中的重要成员,介导RAS与MAPK相结合,调节肿瘤细胞增殖、分化和凋亡。当BRAF基因发生致癌性改变被激活时,会持续磷酸化MEK以及下游的ERK,从而促进肿瘤细胞的生长、增殖及生存。
● 目前,针对RAF的抑制剂有Belvarafenib、 LXH254、 Lifirafenib等。其中LXH254是一种新型RAF抑制剂,能够抑制BRAF和CRAF二聚体和BRAF单体,但不能抑制ARAF,主要用于晚期实体肿瘤中。
● 研究显示,MEK 抑制剂对于无论是KRAS 还是BRAF 突变导致的恶性肿瘤均有显著疗效,尤其是在BRAF 突变(V600E)的肿瘤细胞株中,MEK 通路的负反馈机制不存在,使得此类瘤株对MEK 抑制剂的敏感性大大增加。目前,罗氏的Cobimetinib、诺华的Trametinib和Array的Binimetinib均为MEK抑制剂,其中,Array 的Encorafenib 与 Binimetinib联合用药已被用于治疗转移性黑色素瘤。
● ERK激酶是MEK的唯一下游靶点,靶向于ERK靶点的抑制剂能够有效阻断RAS-RAF-MEK-ERK信号通路,同时能够有效逆转由上游BRAF、MEK突变而导致的耐药。Ulixertinib、LY3214996 均为ERK抑制剂,其中,Ulixertinib 已进入I期临床试验,作为ERK1/2激酶抑制剂,它在BRAF突变和RAS突变细胞系中显示了临床前抗癌活性。此外,国内的恒瑞医药、贝达药业以及德琪医药等,也均已宣布开展ERK抑制剂临床试验。
PI3K信号通路对于MAPK信号通路有重要的补充作用,肿瘤细胞对于MAPK抑制剂的抗药性在很大程度就来自于PI3K信号通路的激活。针对PI3K信号通路,拜耳的Copanlisib于2017年9月14日获美国FDA批准上市,用于治疗复发性滤泡性淋巴瘤,并且于2020年底被CDE纳入突破性治疗品种名单,且已在中国申报上市。
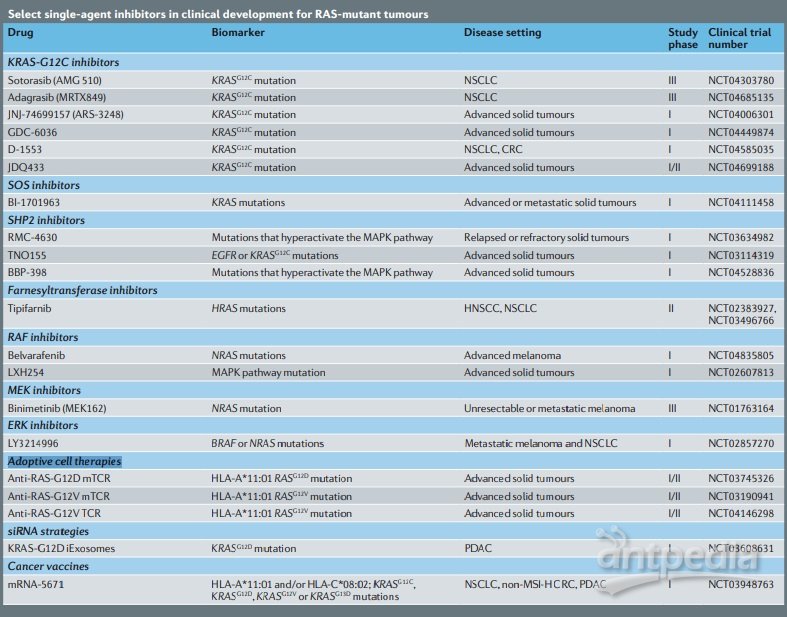
Nature 对单药型RAS靶向药的整理

Nature 对RAS靶向药联合用药的整理
除了以上疗法,还有siRNA疗法、过继细胞疗法、肿瘤疫苗等众多针对RAS突变的疗法等待着临床研究与验证。随着RAS的“不可成药性”被突破,就让我们期待这一领域的更多新进展吧!




















