一文读懂Native ESI-MS如何监测SEC分离过程中蛋白质变性
尺寸排阻色谱(SEC)与非变性电喷雾电离质谱(Native ESI-MS)联用技术是研究天然蛋白质的有效工具。但已报道的研究大多集中于技术应用,并未验证蛋白质在所用分离条件下是否处于原始状态,也未评估SEC洗脱条件对蛋白质-固定相的相互作用和蛋白质变性的影响。近期发表在Analytical Chemistry的一篇文章深入分析了挥发性流动相对SEC-ESI-MS分析过程中蛋白质的保留和离子化的影响。该研究使用不同pH和离子强度的洗脱液,评估蛋白质在SEC分离过程中可能发生的结构变化。选择肌红蛋白作为模型蛋白,通过Native ESI-MS技术分析目标蛋白质,揭示SEC分离后使蛋白质变性的条件和原因。最终,得到用于蛋白质Native SEC-ESI-MS分析的合适条件。
作者等人首先研究了不同流动相组成下肌红蛋白的SEC洗脱行为。使用含有4种不同流动相添加剂且pH和离子强度不同的洗脱液,通过紫外吸收检测(UV)获得肌红蛋白SEC分离谱图。4种流动相添加剂包括:含有硫酸钠和叠氮化钠的磷酸盐溶液(SEC分离的标准洗脱液)、乙酸铵溶液、甲酸铵溶液和碳酸氢铵盐溶液等。通过计算SEC分布系数(Kd值)评估蛋白质与固定相之间的相互作用程度,其中V0和Vi分别是SEC空隙体积和颗粒内体积,而Vr是目标蛋白质的洗脱体积。
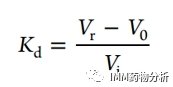
肌红蛋白的SEC-UV谱图(图1A)表明,在较低离子强度条件下(<0.1 mmol/L),磷酸盐与乙酸铵洗脱液洗脱性能更佳,使用甲酸铵、碳酸氢铵洗脱液会导致肌红蛋白峰显著加宽和拖尾。Kd曲线(图1B)表明,低离子强度条件下肌红蛋白的洗脱体积受离子强度和流动相pH的影响,SEC分离过程中存在蛋白质-固定相的相互作用。由此可得出结论,洗脱液的组成、离子强度和pH会影响肌红蛋白的保留行为。在离子强度高于0.1 mmol/L,如pH接近肌红蛋白的pI(7.2)条件下,使用乙酸铵可有效避免蛋白质-固定相之间的相互作用。
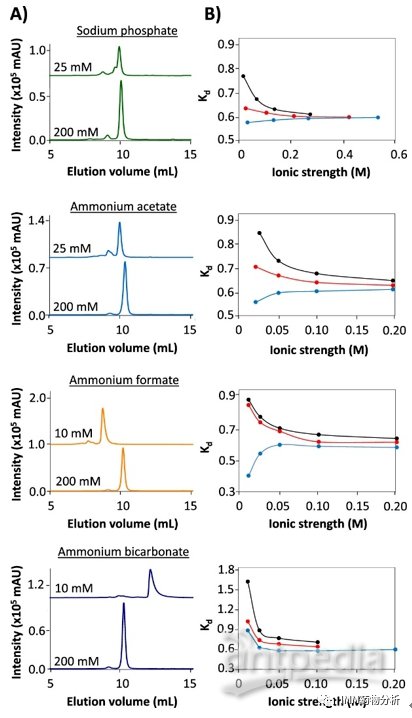
图1 肌红蛋白SEC分离谱图
(A)使用低离子强度和高离子强度的4种洗脱液(pH均为 7.5)分离肌红蛋白得到的色谱图;(B)肌红蛋白Kd值与4种洗脱液离子强度的关系图(洗脱液pH:5.9(黑色),6.9(红色)和7.5(蓝色))
为了评估对肌红蛋白的分析结果是否也适用于其他蛋白质,通过SEC-UV分析了具有不同pI和分子量的蛋白质混合物(图2)。试验用蛋白包括(1)甲状腺球蛋白;(2)γ-球蛋白;(3)卵清蛋白;(4)肌红蛋白;(5)维生素B12的蛋白质测试混合物。使用的洗脱液包括(a)pH 6.9的磷酸钠;(b)pH 6.9的乙酸铵;( c)pH 7.5的甲酸铵;(d)pH 7.5的碳酸氢铵等。SEC-UV实验表明,蛋白质洗脱行为取决于离子强度和洗脱液的性质,只有在高离子强度下,所有蛋白质才能实现无固定相相互作用的SEC分离。
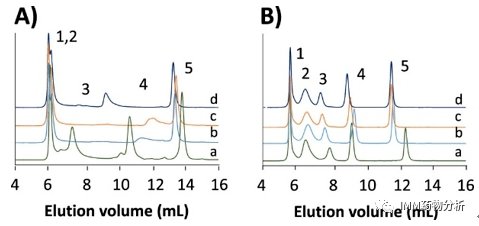
图2 不同pI和分子量的蛋白质混合物SEC-UV分析
(A)低离子强度0.01 mmol/L;(B)高离子强度0.2 mmol/L
随后,研究人员通过肌红蛋白直接进样(Direct-infusion,DI)ESI-MS和经尺寸排阻色谱分离的SEC-ESI-MS实验,分别评估电离和分离过程中潜在的蛋白质变性。DI-ESI-MS结果表明,当蛋白溶于乙酸铵溶液时,肌红蛋白在m/z 1700-2500显示3个强信号,分别对应于[M +10H]10+、[M + 9H]9+和[M + 8H]8+电荷状态,此时肌红蛋白保持其天然构象。当肌红蛋白溶解于甲酸铵或碳酸氢铵时,血红素基团(m/z 616)丢失、高电荷状态质谱峰的出现均表明蛋白发生部分变性,且离子强度增加会导致更多的蛋白变性(图3)。
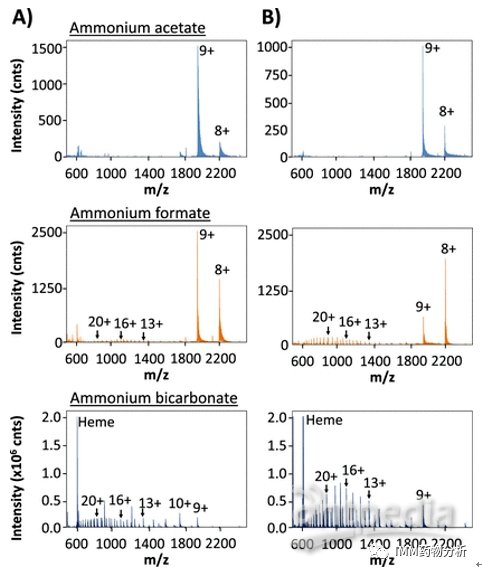
图3 肌红蛋白分别溶于0.01 mmol/L(A)或0.2 mmol/L(B)的乙酸铵、甲酸铵或碳酸氢铵中所获得的DI-ESI-MS质谱图
在SEC-ESI-MS分析时观察到与SEC-UV分析相似的肌红蛋白洗脱行为(图4)。当使用0.01 mmol/L乙酸铵洗脱液时,在SEC-ESI-MS分析获得的肌红蛋白平均质谱图(图4A)中观察到存在大量变性的蛋白(m/z 600-1700)。但是,使用相同的洗脱液DI-ESI-MS仅观察到天然形式的肌红蛋白(m/z 1700-2500)。表明在SEC-ESI-MS分析时,离子强度降低会导致更多的蛋白质变性,而对于DI-ESI-MS,离子强度增加会导致更多的蛋白变性。考虑到SEC-ESI-MS分析时肌红蛋白色谱峰拖尾和蛋白质损失,作者认为蛋白质与二氧化硅固定相之间的非特异性相互作用(静电相互作用、疏水作用等)是导致低离子强度条件下更多蛋白质变性的原因。
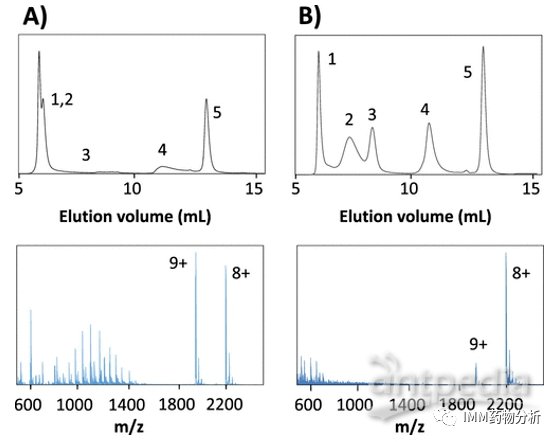
图4 肌红蛋白分别溶于0.01 mmol/L(A)或0.2 mmol/L(B)的乙酸铵中所获得的SEC-ESI-MS质谱图
该研究系统分析了SEC洗脱条件对蛋白质结构完整性的影响。结果表明,在SEC分离时,使用高离子强度、近生理pH的乙酸铵洗脱液能最有效地保持蛋白质天然结构,而甲酸铵和碳酸氢铵会导致更多的蛋白质变性。为保证蛋白质处于天然状态,应在DI-ESI-MS分析时使用低离子强度的乙酸铵溶液,在SEC-ESI-MS分析时使用高离子强度的乙酸铵洗脱液。Native ESI-MS技术可用于确定SEC分离后蛋白质的实际结构,监测蛋白质与固定相之间非特异性相互作用对蛋白质结构的影响。
参考文献
VentouriI K, Malheiro D B A, Voeten R L C, et al. Probing protein denaturation during size exclusion chromatography using native mass spectrometry[J]. Analytical Chemistry, 2020, 92, 6, 4292-4300
文献整理:朱文文;编辑:生宁、张金兰;第168期