杆状病毒-昆虫细胞表达系统2
五、亲代杆状病毒基因组的改进
就像转移质粒的改进,对亲代杆状病毒基因组的改进也是为了满足各种不同的需要。
起初,最主要的目的是找到克服重组杆状病毒载体构建和分离低效率的方法,这也是最初的杆状病毒-昆虫细胞系统存在的主要问题。现在已经知道这个问题的根源在于, 在共转染的昆虫细胞系中,转移质粒和亲代杆状病毒 DNA 的同源重组效率很低。最终,研究人员想出了一些直接和间接的方法来解决这个难题。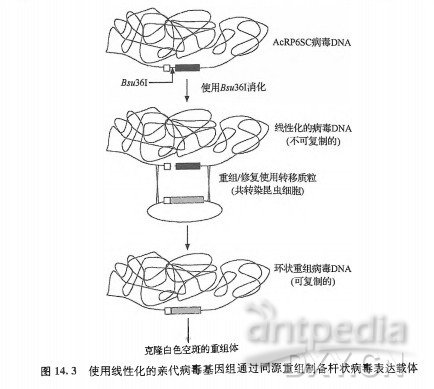
Kitts 和Possee构建出具有线性DNA基因组的杆状病毒,向问题的解决迈出了重要的第一步(Kittsetal.,1990)。这种病毒是通过最初的同源重组方法获得的重组杆状病毒,其主要特点是在多角体蛋白基因座位有一段新的 DNA序列,该序列具有Bw36I的酶切位点(图14.3)。因此, 该基因组能够被5似361线性化并作为亲代病毒 DNA与转移质粒混合后共转染昆虫细胞。这种方法最大的特点是线状的亲代病毒 DNA分子不会复制。因此,线性化在很大程度上减少了共转染昆虫细胞中亲本子代的数量。另外,线状病毒DNA仍然可以与转移质粒进行同源重组,重组后病毒DNA分子重新形成环状结构并恢复复制能力。这些因素加起来,使得共转染的昆虫细胞中重组杆状病毒载体的产生效率从0.1% 增加到10%~20%,也使该技术得到了极大的简化。Kitts和Possee对该方法做了改进,他们构建了一个称为BakPAK6的重组杆状病毒,该病毒可以被Bm36I切开。BakPAK6基因组具有一个位于多角体蛋白基因座位的大肠杆菌^cZ基因,该基因内有一个B361位点,另外还在病毒基因的上游和下游分别引入一个Bsw36I位点(图14.4)。重要的是,经过&M36I的消化,or/1629 的一部分被删除,w/1629是病毒的一个必需基因,它位于多角体基因的下游,编码了病毒核衣壳的鱗蛋白(nucleocapsidphosphoprotein)(VialardandRichardson,1993)。将BakPAK6作为亲代病毒DNA,通过共转染昆虫细胞的方法构建重组杆状病毒载体的效率增加到95%。BakPAK6的成功刺激了多种线性化的杆状病毒DNA的商业化和广泛应用。它们被用做构建重组杆状病毒载体的起始材料。这些商业化的杆状病毒DNA中,最主要的包括ClonTech商业化的原始的 BakPAK6病毒DNA。类似的还有预线性化的称为BaculoGold的病毒DNA(Pharmingen/BDBiosciences)、Novagend的 BacVector、Sigma-Aldrich的 Diamond-Bac。此外,一个称为BaoN-BIue(Invitrogen)的是经过轻微改进的线性化病毒DNA/转移质粒系统, 重组后, 其基因组内的大肠杆菌标志物会得到重建。
在本章的此处,强调这些病毒DNA骨架的发展是很重要的,它们有效地解决了本书第一版出版时在构建杆状病毒表达载体时存在的主要问题。这些线状的杆状病毒DNA被商业公司广泛的市场化并且很快就被生物医学研究机构承认和接受,作为重组杆状病毒构建的改良工具。这些工具和方法 (见下面相关内容)的出现让具有基础分子生物学背景的实验室普通研究人员能够更容易地运用杆状病毒表达载体。最终,杆状病毒-昆虫细胞系统得到了更广泛地应用,并且作为重组蛋白制备的有效工具得到了普遍地认可。
与此同时,Luckow和他的同事们发展了一种与线性化病毒基因组不同的方法来分离杆状病毒载体。他们的方法利用了遗传转座(genetictransposition), 而不是同源重组(LuckowetaL,1993)。该方法通过使用不同的分子机制来产生重组杆状病毒DNA从而使研究人员解决了同源重组的低效问题。该方法的关键在于构建一个新的大肠杆菌菌株, 该菌株具有一个包含完整杆状病毒基因组拷贝的能够自主复制的质粒, 或称杆粒(bacmid)(图14.5)。杆粒的多角体蛋白区域包含大肠杆菌ZacZ基因和mini-AttTn7位点,它是转座的附着位点(attachmentsite)。这株新构建的大肠杆菌菌株还有一个编码转座酶(transposase)的辅助质粒。使用杆状病毒转移质粒转化该新型大肠杆菌菌株,由于转移质粒上的多角体驱动的目标基因的侧翼序列为Tn7附着位点的左端和右端, 该嵌合基因会转座至杆粒上的多角体区域。转座时会导致杆粒上的fccZ基因的删除,这就可以通过在筛选培养基上进行蓝、白斑筛选来鉴别含有重组杆粒的细菌。这样,你就可以从具有白色菌落的大肠杆菌克隆中简便地分离出含有编码目标基因的重组杆粒DNA去转化昆虫细胞。DNA转化会启始病毒的感染并导致子代重组杆状病毒的产生。这种体内转座法可以以100% 的效率产生重组杆状病毒DNA。它的商业化产品最初称为Bac-toBac系统,由LifeTechnologies 公司开发,而现在可以从Invitrogen公司购买。Bac-toBac系统以细菌为中心的特点是很重要的,因为它可以让不熟悉病毒学而更熟悉细菌学和分子生物学的研究人员仍然在自己熟悉的领域工作。但是,该系统存在的一个不足是重组杆状病毒保留了细菌的复制子,与不含有该结构的病毒相比,它使杆粒在昆虫细胞中传代时具有高度的遗传不稳定性[Pijlman等(2003) 及见下文]。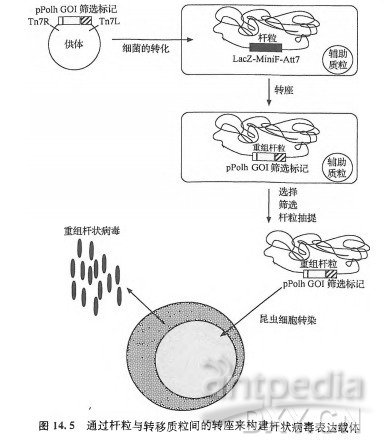
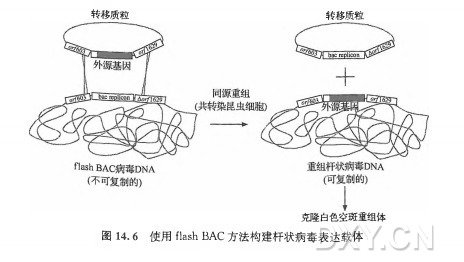
近期,Possee和King的研究小组提出了一种更为聪明的想法,该方法是线性化杆状病毒DNA法和杆粒法的交叉杂合(P0sseeetal.,2008)。从本质上讲,他们构建了一个新型的具有重组杆状病毒基因组的杆粒,该基因组在多角体座位有一个细菌的复制子(replicon)且缺失了下游的烈基因(图14.6)。由于存在细菌复制子及缺失了基因,这个杆粒可以在大肠杆菌中复制, 但是不能在昆虫细胞中复制。因此,可以使用携带有这种杆粒的大肠杆菌方便地制备用于构建重组子代病毒载体的亲代杆状病毒基因组 DNA。你可以简单地从大肠杆菌中分离出病毒DNA,与转移质粒混合后共转染昆虫细胞。在病毒与转移质粒DNA之间的同源重组会同时恢复#/2629,在多角体蛋白基因座敲除细菌复制子并且在相同位置插入目标基因。尽管这种方法没有提高同源重组的效率,但是明显提高了在共转染的昆虫细胞中产生重组杆状病毒的效率,因为亲代病毒DNA 是有缺陷的,不能自我复制。该方法已经由oxfordExpressionTechnologies进行了商业化,产品为flashBAC。flashBAC系统有一个值得再次强调的特点,如上所示, 细菌的复制子在同源重组中被剔除。这样做的优点在于消除了用常规杆粒(保留有细菌的复制子)制备杆状病毒载体时的遗传稳定性问题(Pijlmanetal.,2003)。另一个值得再次强调的特点是在flashBAC系统中使用的杆粒包含了在昆虫细胞中不能复制的缺陷型杆状病毒基因组。显然,这就意味着在该系统中,需要亲代缺陷型病毒基因组与转移质粒之间的同源重组来形成不需要辅助的子代杆状病毒。但是,这并不一定意味着共转染的昆虫细胞将只能产生重组的子代杆状病毒。由于遗传互补作用(geneticcomplementation),这些细胞也能够产生源于缺陷型亲代病毒基因组的子代病毒。特别的是,在共转染的昆虫细胞中产生的重组病毒能够提供的产物,它为缺陷型病毒DNA的顺式装配提供了辅助功能。使用flashBAC系统制备杆状病毒时至少要进行一轮空斑纯化,然而OxfordExpressionSystems的商业文献指出这是不必要的。不进行空斑纯化,通过共转染昆虫细胞获得的原始重组病毒将会污染有缺陷型的亲代病毒, 它们会干扰接下来的载体复制与外源基因的表达。
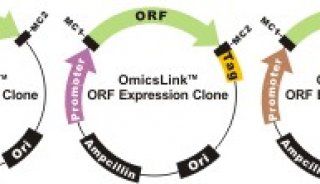
制备杆状病毒载体最简单的途径可能是使用一种交叉杂合了Gateway技术与线性化亲代病毒DNA技术的方法(Hartley,2003;WalhoutetaL,2000)。该方法涉及编码目标蛋白质的Gateway进入质粒(entryplasmid)以及线状的亲代病毒DNA在体外而不是体内的重组。在这个系统中, 亲代病毒DNA以线状的形式存在,其基因组中的多角体蛋白编码序列被大肠杆菌LacZ基因和单纯痕瘆病毒(herpessimplexvirus)胸苷激酶(thymidinekinase)基因替换,替换序列的两侧有噬菌体1的位点特异性重组位点(attRl 和 attR2; 图M.7)(site~specificrecombinationsite)。含有LacZ基因的病毒呈现出蓝色空斑,在添加有某种核苷类似物(nucleosideanalog),如丙氧鸟苷(gancyclovir)的昆虫细胞中培养,胸苷激酶基因提供了针对亲代病毒DNA的阴性选择标记。将线性化的病毒DNA与编码目标蛋白质的 DNA进人质粒混合,目标蛋白质编码序列的侧翼序列为A噬菌体的位点特异性重组序列(attLl和attL2),在混合物中加人纯的重组酶^沈。!^!^-nase)(LRClonase;Invitrogen), 该酶会介导进人质粒和亲代病毒上att位点间的位点特异性重组。需要重点指出的是, 该体外反应是一种非定量意义上的高效重组反应,其产物为亲代杆状病毒DNA与重组杆状病毒DNA的混合物。随后,该混合物通过转染进人昆虫细胞,像前面指出的那样,在含有丙氧鸟苷的培养基中培养,丙氧鸟苷能够阻止亲代病毒的复制。经过一轮筛选,子代重组杆状病毒载体的数目得到增加,通过空斑形成实验可以从相对较低水平的子代杆状病毒背景中将其检出。在,半乳糖苷酶显色底物存在的情况下,重组体的空斑表型为白色,可以依此很容易地将其鉴定出来。这种在体外获得重组杆状病毒载体的方法,最初是由Franke与他的同事在LifeTechnologies研发出来的。
然后由Harwood和他的同事在Invitrogen将其商品化为BaculoDirect系统。该系统使用起来非常地快速、有效和简单。但是,需要着重指出,与flashBAC系统类似,BaculoDirect系统在市场上被宣传为「无需空斑纯化或细菌中的筛选,即可从杆状病毒克隆与表达基因」,就像前面指出的那样,这不是好的建议,尽管胸苷激酶基因产物和丙氧鸟苷的存在会对亲代病毒产生一个负向选择压力,但用体外重组产物转染的昆虫细胞仍然既会产生重组体子代又会产生亲代病毒的子代。因此,研究人员在使用BaculoDirect系统时不要轻信厂商宣称的内容,相反应进行至少一轮的空斑纯化将具有目标基因的重组杆状病毒从亲代病毒污染中分离出来。事实上, 那些接受了该建议并且使用了含有,半乳糖苷酶的琼脂层进行空斑纯化的研究人员通常至少会看到一些蓝色的斑点,这显示亲代病毒的存在并肯定了对重组杆状病毒的空斑纯化是明智的决定。公平地说,商业化的BaculoDirect系统的操作手册(Invitrogen)包括了在含有/■半乳糖苷酶的培养基上进行空斑纯化的方法,这提供了很大的便利。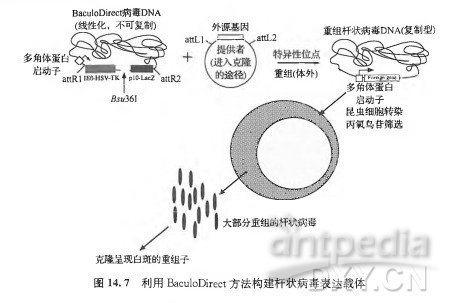
在了解了上述体外重组方法的基础上,还应对一些已经公开出版的直接体外重组DNA法进行简短的介绍。这些方法涉及对改进后的杆状病毒基因组进行消化及其后与外源DNA片段的直接连接。这些方法的一个实例涉及在AcMNPV基因组上多角体蛋白启动子下游引入两个&m36I位点(LuandMiller,1996)。这两个位点的识别序列有着微小的差异。经&w36I位点消化后产生5’-TTA^的单链突出序列(singlestranded5’-TTA-3’overhangingsequence),该序列可以在dTTP存在下被大肠杆菌DNA聚合酶IKlenow片段转化为 5~TT-3’的单链突出。这就产生了一个线性的杆状病毒DNA分子,任何DNA片段都可以与其进行连接,只要它经过Ec0RI酶切后产生y-AATT-3’的单链突出,然后再经Klenow片段和dATP处理为V-AAW的单链突出。这种改进的主要目的在于给以杆状病毒为基础的cDNA表达库的构建提供方便。其他两个直接体外重组的实例都涉及在杆状病毒基因组中引人归巢内切核酸酶(homingendonuclease)的酶切位点。其中一个是在AcMNFV基因组中引入一个I-Sce-I位点来构建一个命名为Ac-Omega的重组体(Ernstetal.,1994)。分离自该病毒的基因组DNA可以被I-Sce-I消化后与被同样的酶处理过的DNA片段连接。另外一个被命名为Homingbac系统,它涉及在许多不同的杆状病毒基因组中引入一个单一的I-Cew-I位点(Lihoradovaetal.,2007)。从这些病毒中分离的基因组DNA被I-Cew-I线性化后可与用BsfXI处理后具有可匹配突出末端的DNA片段连接。目前,本段描述的3种直接克隆的载体都没有实现商品化,在文献报道中该方法也应用得不多。因此,很难对这几种直接克隆方法是否相对成功或者其杆状病毒骨架能否广泛用于制备杆状病毒表达载体作出评估。
除解决关于重组杆状病毒载体构建的早期技术难题外,一些对亲代杆状病毒基因组进行改进的目的是增强重组载体上外源蛋白的表达。基本的做法是删除这样的一些杆状病毒的基因:①已知这些基因对病毒在培养的昆虫细胞中的复制是不需要,暂且定义为「附属」(accesSory)基因;②认为这些基因通过某些方式干扰了外源蛋白的产生或降解目标蛋白质。此类杆状病毒DNA是最初由Bishop和同事们研发出的线状病毒DNA,后来被Novagen商品化为BacVector-2000。除多角体蛋白外,这种病毒DNA还缺少其他5种未公开的附属基因。缺失这些基因对于外源蛋白产量的影响一直都不清楚,因为没有相关报道用这些基因缺失与否的杆状病毒DNA进行外源蛋白表达量的对比研究。
接着, 另外两个非必需基因: 一个编码几丁质酶(Hawtinetd.,1995), 另一个编码组织蛋白酶样蛋白酶(cathepsin-likeprotease)(Slacketal.,1995) 在BacVector-2000被剔除,所形成的以AcMNPV为基础的亲代病毒DNA被称为BacVector-3000(Nova-gen)。其他的以AcMNPV为基础并缺失了病毒几丁质酶和组织蛋白酶样蛋白酶基因的病毒包括一种被称为BestBac(表达系统)的商业化的杆粒和一种未商业化的称为八出扣-DCC(Kabaetal.,2004)的经修饰的杆粒。flashBACtm系统中使用的杆粒同样缺少有功能的几丁质基因。亲代病毒上几丁质酶和组织蛋白酶样蛋白酶的缺失对重组杆状病毒载体的子代病毒的外源基因表达的影响并不是完全清楚,但还是有一些资料可以参考。
其中一项研究表明,缺失这两种酶的AcBacDCC表达的一个外源糖蛋白比含有这两种酶的杆状病毒载体表达的糖蛋白更不容易降解(Kabaetal.,2004)。这似乎与预期是一致的,删除病毒蛋白酶基因通常会促进重组蛋白和分泌蛋白更好地表达。但是, 还需要做更多的工作来确定剔除某个特定的蛋白酶基因是否会广泛的影响外源蛋白在杆状病毒-昆虫细胞系统中的生产。目前还比较少观察到删除病毒几丁质酶基因的潜在影响。曾有研究显示, 病毒几丁质酶驻留在内质网上,它通过饱和宿主蛋白转运机器来干扰分泌途径蛋白的产生(Kabaetal.,2004)。如果上述机制是事实, 那么删除病毒几丁质酶基因从而达到没有几丁质酶的目的, 这样可能会增加分泌蛋白的表达水平。但是,目前还没有公开出版的研究证明单独删除以AcMNPV为基础的载体, 如flashBAC上的几丁质酶基因所产生的影响。研究显示,缺失了几丁质酶的AcBacDCC表达的外源蛋白降解减少, 但该病毒同时缺失了组织蛋白酶样蛋白酶,这使得结果的解释变得复杂化。另外,已有一篇出版的文献显示单独或全部剔除重组丝虫杆状病毒(recombinantsilkwormbaculovirus)的几丁质酶或组织蛋白酶样蛋白酶基因对外源蛋白生产的影响[家蚕核型多角体病毒Bombyxmorinucleopolyhedrovirus,(BmNPV),Leeetal.,2006]。在这个系统中,编码昆虫纤维素酶(Cellulase)的重组BmNPV载体在删除几丁质酶或组织蛋白酶样蛋白酶基因时在蚕中表达的外源蛋白具有更高的水平和更好的酶活性。而且,用缺失这两种病毒酶基因的载体可以获得具有最高酶活性、最高表达量的纤维素酶。你会推测这些结果显示从AcMNPV为基础的载体删除病毒几丁质酶基因会有类似的效果。但是,由于在这个研究中是以蚕(silkworm)而不是以昆虫细胞系作为宿主, 这种推测的合理性会被削弱。
DiamondBac是另一个通过删除非必要基因在杆状病毒-昆虫细胞系统中增强重组蛋白表达量的亲代杆状病毒DNA的例子。如上所述,DiamondBac是与BakPAK6类似的商业化的、预先线性化的杆状病毒DNA,但是这种病毒DNA还缺少有功能的WO基因,有研究显示,该基因与宿主细胞的裂解有关(WilliamsetaL,1989)。因此,制造商的商业文献指出,用该亲代病毒产生的重组杆状病毒载体感染的细胞会在感染过程中一直保持较高的细胞活性,这会有助于提高重组蛋白的表达水平(Sigma-Aldrich,2008)。
DmmondBac的另一个让人感兴趣并有潜在用途的特点是,在杆状病毒基因组中的W0基因被蛋白二硫化物异构酶(proteindisulfideisomerase,PDI)基因替代,该基因编码的一种伴侣蛋白能够促进二硫键的形成并有助于蛋白质的折叠。已有公开出版的证据表明,在杆状病毒-昆虫细胞系统中共表达PDI, 可以提高重组IgG的可溶性和分泌水平(Hsuetal.,1996)。Sigma-Aldrich的商业文献指出,WO基因的缺失以及PD7基因的插入可以将多数重组蛋白的总产量提高接近10 倍。但是,没有公开发表的研究对重组杆状病毒载体有无WO基因缺失或PDI基因插入情况下外源蛋白的生产水平进行比较。
因此,在最终的分析中, 为了直接确定非必须病毒基因,如病毒的几丁质酶基因、组织蛋白酶样蛋白酶基因和朽o基因的缺失对在杆状病毒-昆虫细胞系统中进行蛋白质生产的总体影响, 需要对合适匹配的AcMNPV来源的载体进行直接比较研究。
除了DiamondBac亲代杆状病毒DNA外, 已有文献报道有人设计出插入了编码外源蛋白加工酶基因的杆状病毒载体,以此来提高外源蛋白的产量。这之中就有一个重组杆状病毒载体具有在P]0启动子控制下的多分 DNA 病毒(polydnavirus)wai^yri77基因(Fath-Goodinetal.,2006)。已经发现某些基因的表达产物可以延长被杆状病毒转染的 Sf9 细胞存活时间,这相应的就能够提高在多角体蛋白启动子控制下共表达的外源蛋白的产量。其他可以归为此类的杆状病毒载体包括具有在杆状病毒id启动子调控下的外源糖基转移酶(glycosyltransferase)基因(Jarvisetal.,2001;Tomiyaetal.,2003)或与磷酸胞苷唾液酸(CMP-sialicacid)生物合成相关的酶的基因(Hilletal.,2006)的载体。在载体中使用早期启动子, 可以在感染的早期表达这些具有加工功能的蛋白质,使其表达远远早于外源蛋白的表达。这就使得昆虫细胞的内源性N-糖基化功能得到延伸,在目标糖蛋白开始表达之前就具有了对蛋白质进行人源糖基化的能力。
一种转移质粒可以同时将多分 DNA 病毒基因和外源蛋白的基因引入到杆状病毒基因组中,Paratechs已将这种质粒商品化。类似的,在不久的将来,具有更高级真核iV-糖基化功能的亲代杆状病毒DNA会被商业化并用于制备重组杆状病毒。这些重组杆状病毒的出现会使对这些类型的病毒载体增加蛋白质表达水平的能力或生产人源化糖蛋白的能力进行全面评估变得更加方便。目前, 未曾使用大量的外源蛋白/糖蛋白对这两方面的能力进行过评估。
六、杆状病毒-昆虫细胞系统的另一半
考虑到目前为止本章的重点都放在了杆状病毒表达载体上,很有必要提醒读者,杆状病毒-昆虫细胞系统是一个由两个部分组成的二元系统。当然,第一个部分就是杆状病毒表达载体,它是一个昆虫病毒,其功能显然就是将编码目标蛋白质的外源基因导人宿主细胞中。杆状病毒表达载体的另一个功能是为在晚期或极晚期启动子控制下的目标基因的转录提供所需的转录复合物。第二个部分就是到目前为止几乎没有提及的宿主,通常是鳞翅类昆虫细胞系,但有时是鳞翅类的昆虫。
鳞翅目昆虫(OrderLepidoptera)包括蛾(moth)和蝴蝶(butterfly),它们是杆状病毒家族中多种病毒(包括AcMNPV)的宿主。Grace在1%2年第一个建立了鳞翅类昆虫细胞系(Grace,1962)。至今,已经建立了超过250种昆虫细胞系(Lynn,2007)。但是, 我们重点关注两个杆状病毒表达载体最常用的鳞翅类昆虫细胞系。其中一个是Sf9, 由Smith和 Summers在1987年亚克隆IPLB-SF-21而建立的,IPLB~SF-21细胞系是在1977年从草地贪夜蛾(Spodo卿ra/rwgipenia, 又称为秋天行军虫)的卵巢组织中分离出来的 Sf9 细胞可以在很多商业公司购买到,如Invitrogen和Novagen或者美国模式菌种收集中心(AmericanTypeCultureCollection,ATCC)。另外一种是HighFive, 最初是从粉纹夜蛾m’,又称为甘蓝银纹夜蛾(cabbageIooper)]的成熟卵巢组织中分离到的细胞系,在1992年由Granados和Wood的小组称为BTITn5B-1,后被Invitrogen商业化为HighFive。
Sf9和HighFive两种细胞系的一个有趣的特点是二者都能够以贴壁或悬浮状态生长。由于这个特点,通过感染数以百万计的在培养板或培养瓶中生长的 Sft或 HighFive细胞,可以很方便地进行实验室规模的蛋白质生产实验。贴壁生长的 Sf21或Sf9 细胞也常规用于空斑筛选和重组杆状病毒表达载体的定量。另外,Sf9和HighFive两种细胞都能够在转瓶(spinnerflask)、摇瓶(shakeflask)、气升式搅拌槽(airlift,stirredtank)、Wave生物反应器(Wavebioreactor) 中扩大规模来生产大量的重组蛋白。
昆虫细胞培养的条件和方法与大多数研究人员所熟悉的哺乳动物细胞的培养方法大不相同。例如,培养昆虫细胞的最适温度是28°C而不是37°C另外,Sft和HighFive
细胞贴壁不紧, 在传代培养时不需要EDTA或胰酶(trypsin)处理。昆虫细胞的生长不需要含有CO2的培养箱,因为昆虫细胞培养基是用磷酸盐作为缓冲液而不是碳酸盐。Sf9和HighFive细胞都可以在有或没有血清的培养基中生长, 这两种培养基的来源都很广。事实上, 从1990年本书的第一版面世以来, 多种不同的昆虫细胞培养基都能够从多个不同的制造商那里买到,其中最主要的包括ExpressionSystems、Invitrogen(GIB-CO)、HyClone和Sigma-Aldrich。但是,需要指出的重要一点是,Sf9和HighFive细胞会倾向于逐渐适应某种特定的培养基。因此, 突然地将Sft和HighFive细胞的培养基由有血清培养基变换为无血清培养基会导致培养细胞的损失。一个更容易成功的做法是缓慢戒除血清法。例如,在连续的4次传代中,你可以将无血清培养基的比例从0% 依次升高至25%、50%、75%,直至100%。即使使用这种相对缓慢的血清戒除法,当将细胞刚刚置于不含血清的培养基时,这些细胞也会经历短暂的生长停止或生长缓慢。因此, 保持耐心非常重要,因为这些细胞会在新培养基中迟滞生长12天后恢复正常的生长速率。
缓慢血清戒除法不仅对从有血清培养基到无血清培养基的转换有用,还可以用于将昆虫细胞从一种无血清培养基转移到另一种无血清培养基。