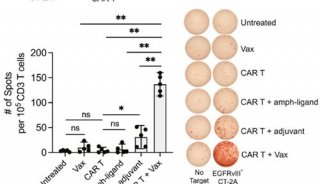
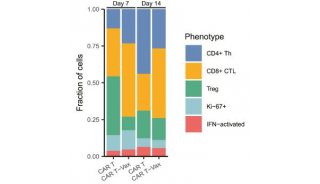
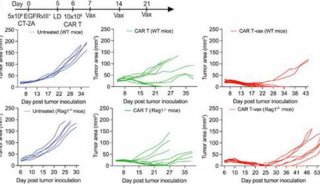
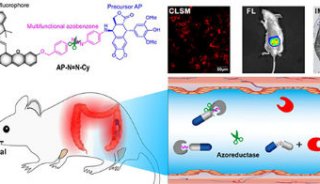
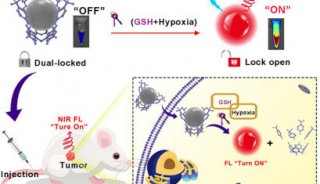
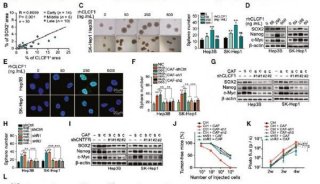
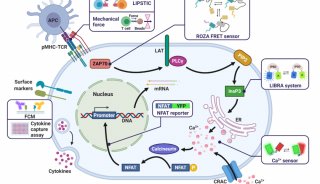
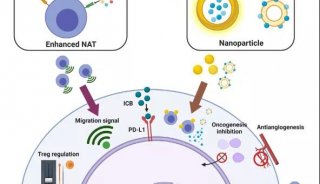
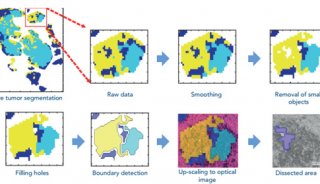
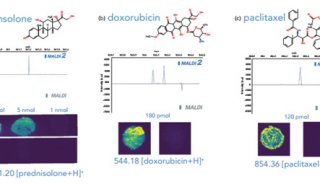
同济大学,上海交大首发性成果登JCI封面
近日,国际著名医学研究学术期刊《The Journal of Clinical Investigation》在线发表了同济大学医学院徐国彤教授与上海交大医学院/中科院上海生科院健康科学研究所金颖研究员合作完成的题为“WNT signaling determines tumorigenicity and function of ESC-derived retinal progenitors”的研究成果,首次阐明胚胎干细胞(ESCs)来源的视网膜前体细胞(ESC-RPCs)的治疗作用和肿瘤形成的机理,为研发干细胞治疗视网膜变性方法提供了理论和实验依据。
视网膜变性疾病是全球性重要致盲眼病,目前尚缺乏有效治疗手段。有研究表明:在实验动物和临床实践中,视网膜下腔移植新生小鼠RPCs治疗视网膜变性疾病安全、有效,但是人类不可能从新生儿眼获取RPCs去进行治疗。
ESCs具有分化为包括视网膜细胞在内的各种类型细胞的潜能,为临床提供充足的供体细胞来源。但ESCs的发育全能性和持续的自我更新能力也使其在移植治疗中存在形成肿瘤的危险。如何在细胞移植前将ESCs在体外诱导分化为能有效再生视网膜但不会形成肿瘤的供体细胞,是应用干细胞治疗疾病需要解决的关键问题,也是本研究努力回答的重要科学问题。
论文的共同第一作者是健康科学研究所博士研究生崔璐(现为上交大医学院助理研究员)和管圆(现为同济大学医学院博士后)。
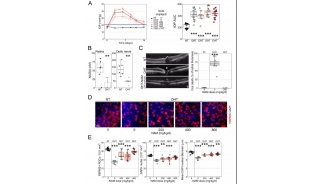
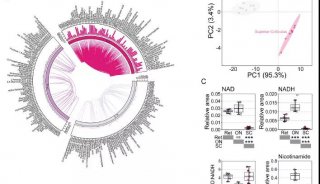
该研究在金颖和徐国彤两位教授(共同通讯作者)指导下,利用视网膜变性小鼠模型开展细胞移植实验,结合全转录本芯片的检测,发现经典Wnt通路在ESC-RPCs中异常激活,并在调控治疗效果和肿瘤形成中起关键作用。
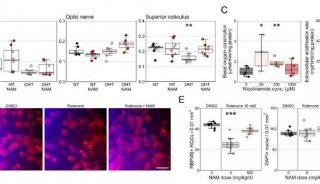
结果证明,在细胞移植前,应用Wnt抑制剂处理ESC-RPCs能显著地提高移植细胞对动物视力的保护作用并减少移植细胞引起的肿瘤形成。深入研究发现,经典Wnt信号通路的下游因子Tcf7通过直接调控Sox2和Nestin的表达而参与调控干细胞的神经分化和肿瘤形成过程。不论是沉默ESC-RPCs中的Tcf7还是Sox2或是Nestin,都能有效降低肿瘤的发生率,同时提高供体细胞在受体视网膜中的整合并促进受体小鼠视功能的恢复。
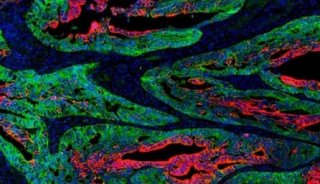
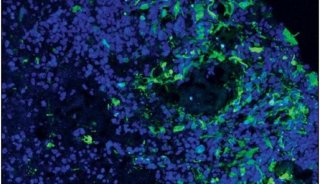
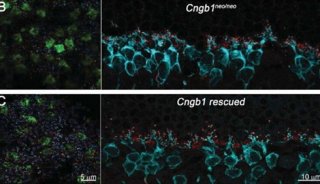
该研究首次证明Wnt-Tcf7-Sox2-Nestin信号通路在调控ESC-RPCs移植后的整合和肿瘤形成中的重要作用,即经典Wnt信号通路通过调控Tcf7影响Sox2和Nestin的表达水平决定供体细胞最终是发挥治疗作用还是形成肿瘤。这一研究为临床上移植ESC来源的供体细胞治疗视网膜变性和其他神经退行性疾病奠定了重要基石,是干细胞转化研究的重要进步。该研究被JCI选为当期封面论文(封面图片选自该论文,显示小鼠神经视网膜结构),并有评论文章在同期发表。
(JCI封面)
-
项目成果
-
焦点事件

-
科技前沿
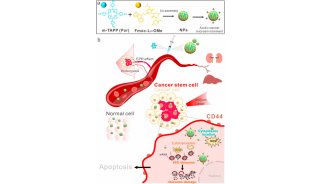
-
项目成果
-
科技前沿

-
项目成果

-
科技前沿
-
科技前沿
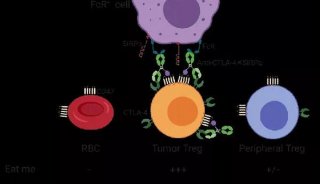
-
科技前沿

-
科技前沿

-
科技前沿
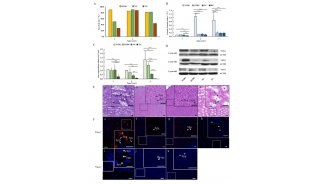
-
科技前沿

-
科技前沿
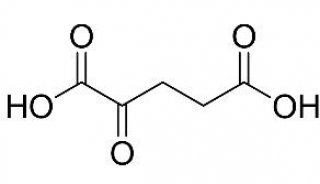
-
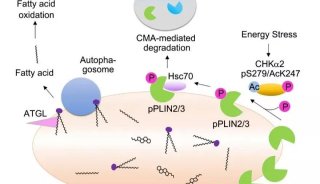
技术原理
-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
-
技术原理
-
项目成果

-
项目成果
-
科技前沿
-
焦点事件

-
科技前沿
-
项目成果
-
项目成果