空间蛋白质组学:一种强大的细胞生物学发现工具
真核细胞高度区室化,生物过程被分隔在不同的区室进行。蛋白质功能与亚细胞定位密切相关,不同的区室提供不同的化学环境(例如pH和氧化还原条件)、不同的潜在作用配体或底物。因此,对蛋白质亚细胞定位的严格控制是细胞生理学的重要调控内容。
大多数细胞生物学过程涉及蛋白质亚细胞定位的变化,例如转录因子在细胞核-胞浆的穿梭、细胞凋亡过程中线粒体蛋白的重新定位,以及细胞表面信号传导受体的内吞等。相反,蛋白质的错误定位通常与细胞功能障碍和疾病相关,包括神经变性、癌症和代谢紊乱等。
以蛋白质空间定位为研究方向的空间蛋白质组现在已经用于揭示人类蛋白质组的复杂结构,如单细胞变异、动态蛋白质易位,相互作用网络改变,以及蛋白定位改变等。一些研究者也已成功运用空间蛋白质组学来研究疾病,包括急性病毒感染、肝病等。
2019年5月,KTH 瑞典皇家理工学院的 Emma Lundberg 教授和德国马克斯-普朗克研究所的 Georg H. H. Borner 教授,在国际著名期刊 Nature Reviews | Molecular Cell Biology(IF=35.612)发表了题为《Spatial proteomics: a powerful discovery tool for cell biology》的综述性文章,系统介绍了空间蛋白质组学的技术、未来发展的机遇与挑战。下面小编为大家解读一下这篇综述。

目前三种互补的方法可用于空间蛋白质组学研究:细胞器分级的质谱分析(图1)、蛋白质与蛋白质互作网络分析(图2),以及基于蛋白质定位的蛋白质成像(图3)。
1)基于质谱的细胞器分级方法
质谱可用于复杂混合物中蛋白质的定性和定量研究。空间蛋白质组学可借助传统生物化学分析方法,如下图1a 所示,通过定制的亚细胞分级分离(如,梯度离心或差速离心)来富集目标细胞器(绿色)。然后利用质谱方法只分析富集到的组分。此方法鉴定出来的蛋白质包含目标细胞器蛋白和共富集污染物(红色和蓝色),且无法区分,因而不推荐。
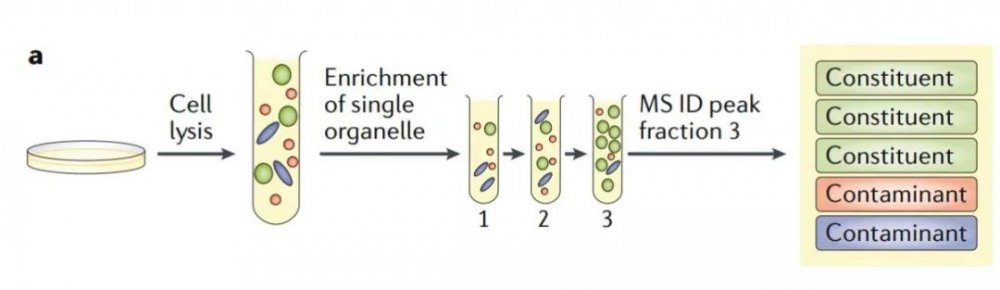
图1a 空间蛋白质组学基于质谱进行细胞器分级分析
下图1b 为单细胞器分析法,定量质谱方法可对目标馏分和某几个相邻或相近馏分进行检测。对于每种蛋白质都可获得丰度分布曲线。此方法可通过统计分析区分污染物(红色和蓝色),污染物可被识别,但却不一定能分解为不同的类别。
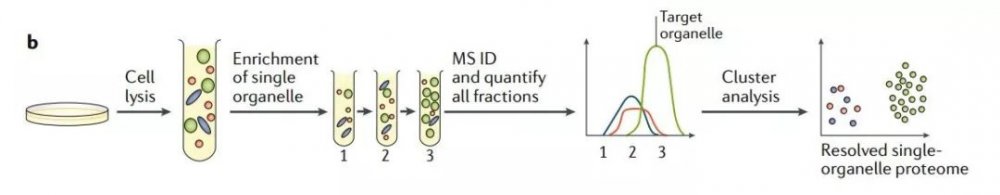
图1b 单细胞器分析法
下图1c 为多细胞器分析法,应用亚细胞分级方案,同时分离所有的细胞器。由于没有进行细胞器“纯化”,因而细胞器很大程度上重叠分布。之后对亚细胞分级进行定量质谱分析。每个细胞器都有自己独特的蛋白轮廓,通过对蛋白聚类分析,并使用已有的细胞器标记,对聚类蛋白进行注释。
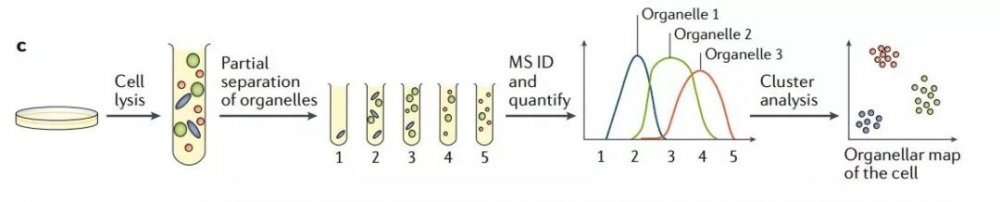
图1c 多细胞器分析法
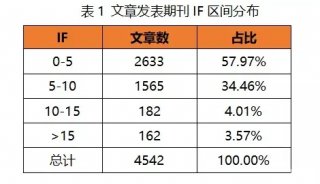
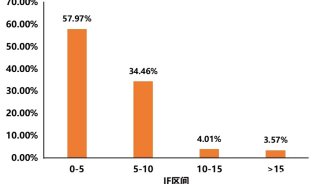
目前基于多细胞器分析的质谱方法,在细胞器分离方法、质谱定量策略,以及生物信息分析方法上,衍生出多种技术改进方案。不论何种方案,过去3年发表的多细胞器分析的应用中,都实现了非常高水平的细胞器分辨率(≥10个亚细胞区室)、蛋白质组学覆盖率(> 5,000个蛋白质),以及分类的准确率(通常> 90%)(表1)。
表1.基于质谱的多细胞器分析的当前实施方式

另外值得一提的是,由于质谱的高分辨率,细胞器质谱图本质上提供了大量潜在的相互作用的组学数据。如,作为同一复合物的蛋白质在细胞器图谱上显示为微团簇,这一特征可用于鉴定新型蛋白质复合物(图1d)。此外,细胞器图谱原则上可提供肽段水平的分辨率(图1e),并揭示不同的蛋白质剪接体、蛋白水解加工形式,以及与翻译后修饰相关的多种定位差异。随着质谱技术的进一步发展,基于肽水平的细胞器定位可能会为解开蛋白质亚细胞定位的复杂性做出重大贡献。
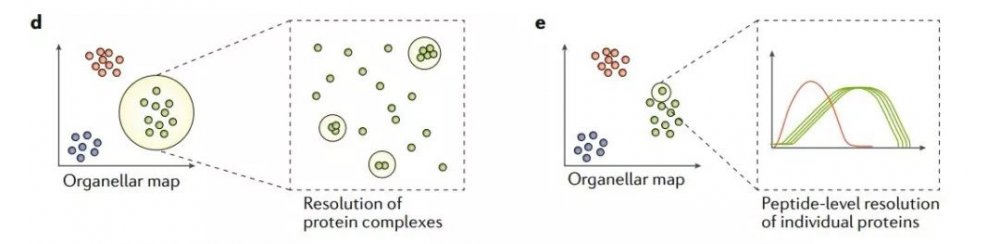
图1de 空间蛋白质组学基于细胞器质谱图进行细胞器分级分析
2)基于蛋白互作网络的空间蛋白质组研究方法
蛋白质-蛋白质相互作用普遍使用基于质谱的、抗体介导的亲和纯化-MS(AP-MS)来进行研究。使用抗体从复杂样本(如全细胞裂解物)中亲和纯化蛋白质及其结合配体,后续 MS 分析鉴定(图2a)。
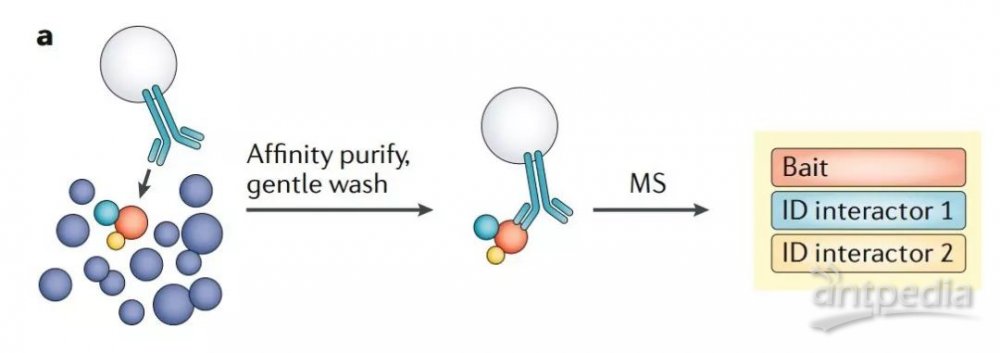
图2a 通过蛋白互作网络研究空间蛋白质组学
从概念上将,由于相互作用的蛋白必须位于相同的亚细胞位置,所以蛋白质的相互作用组可以认为是“局部”的空间蛋白质组。使用相互作用的诱饵蛋白进行多个 AP-MS 实验,也可以揭示一个具有空间信息的蛋白关联网络(图2b)。
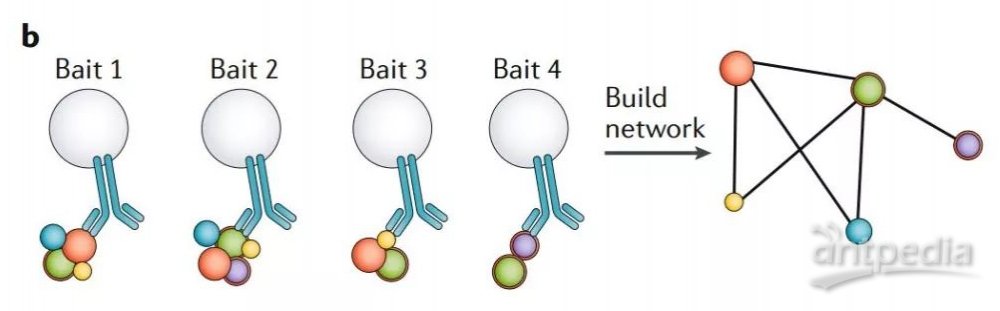
图2b
邻近标记法对于细胞器的 AP-MS 十分有帮助。诱饵蛋白可以使用人工合成的抗坏血酸过氧化物酶(APEX)或生物素连接酶(BioID)进行标记。生物素连接酶可以催化诱饵蛋白紧邻(<10-20nm)蛋白质的生物素化。因而质谱分析的靶标蛋白不仅包括诱饵蛋白、与诱饵蛋白直接结合的配体,还包括瞬时相互作用的蛋白,以及位置紧密相连但不直接结合的蛋白(图2c)。由于少量诱饵蛋白便可获取丰富的空间信息,因而此方法可以在不需要亚细胞分级的情况下获得全面的区室蛋白质组(图2d)。
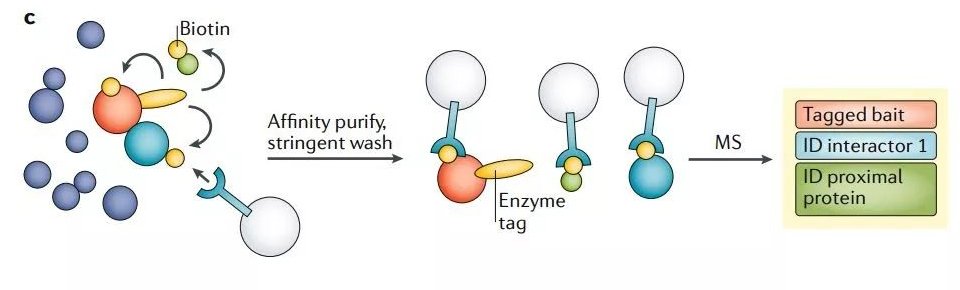
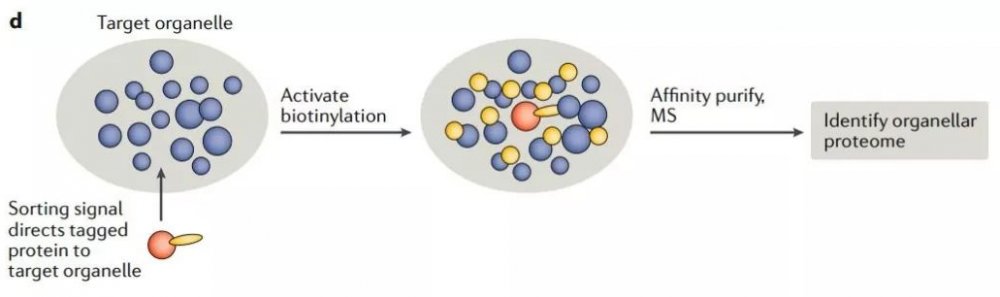
图2cd
当在同一系统中进行多个 AP-MS 或邻近标签标记实验时,诱饵蛋白和结合配体会在不同实验中重复出现(如在b部分中)。来自相同亚细胞定位的多个诱饵蛋白会揭示各个区室的详细图谱,而区室与区室又通过相互间的映射连接,最终便可以构建细胞全部亚细胞区室的空间蛋白质图谱(图2e)。
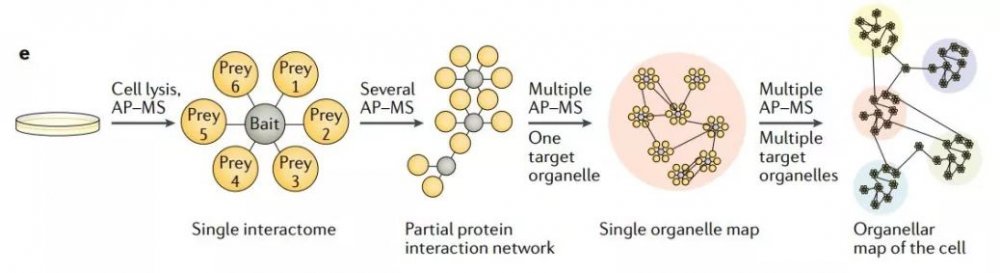
图2e
3)基于成像的空间蛋白质组方法
基于成像的空间蛋白质组学提供了在自然细胞环境下可视化研究蛋白质的机会,而不需要在蛋白质组学分析之前进行细胞裂解或细胞器的分离(图3)。基于成像的蛋白质定位便于研究具有多模式细胞器定位的蛋白质研究,实际上大多数的蛋白质也是定位于多个亚细胞区室的。此外,越来越多的研究表明,遗传背景相同的细胞群体也会在蛋白表达水平、蛋白定位上表现为差异。基于成像的空间蛋白质组学技术有助于通过捕获单细胞分辨率下的蛋白空间分布来研究这种可变性。蛋白质的可视化成像,通常使用抗体,或荧光蛋白的融合表达来实现。
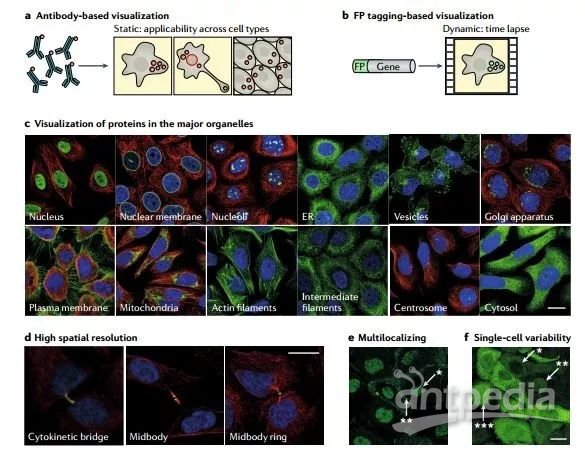
图3. 基于成像的空间蛋白质组的多种处理方式
许多因素使得细胞蛋白质组比仅从基因数目进行的蛋白预测,要复杂的多。空间蛋白质组则最有希望解开这种有趣的细胞复杂性。
1)帮助识别多定位和“兼职”蛋白,了解细胞复杂功能
约50%的人类蛋白是定位于多个亚细胞区室的。这些蛋白质是否具有特定的兼职功能?“兼职”(Moonlighting)蛋白被定义为具有两种或更多不同细胞功能的蛋白质,这些细胞功能不是由遗传变异、RNA 剪接或基因多重效应引起的,而是由亚细胞定位,底物,寡聚化或翻译后修饰(PTM)的差异引起的。已知的兼职蛋白数量正在迅速增加。据估计,23%的人体蛋白质是兼职蛋白。78%的已知兼职蛋白参与疾病发生发展,48%是目前的药物靶点。基于成像的空间蛋白质组学将是识别多定位蛋白质的关键技术,以更好地理解它们在复杂细胞功能中的关键作用。
2)帮助发现多种蛋白质存在形式(Proteoforms)
蛋白质的每种分子形式都称之为一种蛋白质形式,这种变化主要是由于 DNA 序列的变异性,RNA 剪接和不同的翻译后修饰,如磷酸化,泛素化,烷基化和糖基化所引起的。典型的人类细胞预估含有600万个共存的蛋白质形式。虽然这个数字远远低于理论上可能的组合数量,但它揭示了蛋白质组的巨大复杂性。基于质谱(MS)的空间蛋白质组学,可以提供关于蛋白质存在形式和亚细胞定位的新见解。
3)获取蛋白质丰度信息
人体细胞蛋白丰度跨越7个数量级,为了模拟细胞的生物学过程,需要了解每个细胞的绝对蛋白的数目及其变化。基于质谱和基于成像的空间蛋白质组学,可以提供这些信息。
4)获得蛋白质层面的单细胞变异性信息
越来越清楚的是,遗传上相同的细胞群显示出蛋白质表达的变异。我们对这种细胞异质性的后果的理解仍然不成熟。基于成像的方法可能在阐明致病因素方面起关键作用。
5)了解蛋白质定位的动态信息
蛋白质亚细胞定位受到严格控制,许多蛋白质响应刺激,扰动或疾病而改变定位。全球比较空间蛋白质组学,基于成像,基于相互作用或基于 MS,提供了在系统水平捕获这些生理和病理蛋白质易位的理想工具,并且应该成为细胞生物学家的广泛发现工具。
综上,基于质谱与成像的空间蛋白质组有助于全面了解细胞的复杂性。而且后续空间蛋白质组学与其他组学的结合,也将利于发现更多的生物信息。例如,转录组学可以提供细胞特异性表达,如剪接变体、单核苷酸多态性等数据信息,从而使空间蛋白质组学能够发现新的蛋白质形式。空间蛋白质组学与代谢组学的结合,可以在功能上发现细胞器重排与代谢变化的相关性。与之类似地,RNA 测序与空间蛋白质组学相结合,有可能将 mRNA 与亚细胞定位联系起来。因此作者认为,空间蛋白质组学应该成为细胞绘图工作中的整合技术,例如人类细胞图谱,旨在表征所有人类细胞类型。
参考文献:
Spatial proteomics: a powerful discovery tool for cell biology. Lundberg E, Borner GHH. Nat Rev Mol Cell Biol. 2019 May;20(5):285-302. doi: 10.1038/s41580-018-0094-y.