高效的长期延时拍摄技术
研究球状体的形成
当对球状体做延时拍摄技术时,会出现某些挑战。由于实验可能持续数天,必须实现长时间的样本存活,这就需要确保接近生理条件。本文描述的长期延时研究使用了全场景显微成像分析平台MICA来研究U343和MDCK细胞球形成。细胞球生长需要最佳条件,以确保细胞周期和增殖不受干扰。
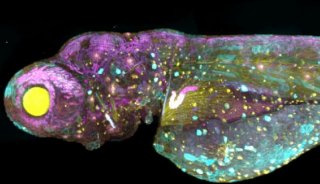
图像:每孔1000个被稳转了MX1 GFP(绿色)的MDCK细胞形成的3D细胞球。72小时延时拍摄,间隔30分钟。灰色是IMC。
延时拍摄技术
延时拍摄技术[1,2] 是指在一定的时间内,通过显微镜以特定的速率(通常为帧/秒(fps))捕捉标本的图像。
如果图像捕获率低于用于观察记录图像的观察率,那么在观察像视频一样的图像序列时,时间就会显得更快。同样,如果图像捕获率高于观察率,那么时间似乎就会变慢。因此,延时显微镜检查能够观察到长时间的微观事件,即在几分钟、几小时或几天内发生的事件,在几秒钟、几分钟或几小时内就能看到。延时显微镜检查用于研究活体标本,如细胞培养物、急性组织样本和模式生物随着时间的推移而生长和发展,以获得更多关于生物过程的见解[3,4]。
例如,在胚胎发育、组织修复、免疫系统功能和肿瘤细胞侵袭过程中,细胞迁移对多细胞生物体非常重要。为了准确跟踪细胞和生物体随时间的变化,可以采用“纵向”研究[5] ,即在规定的时间内,在特定的条件下观察同一样本或标本。
细胞球
细胞球是一种三维细胞培养,就像类器官一样,它模拟活体组织和器官的生理功能[6]。单层二维细胞培养物通常是在基质上平坦生长的细胞,细胞球和其他3D细胞培养物则可以大量生长,从而实现细胞-细胞之间的三维相互作用,这更像有机体中的原生组织。这些3D细胞培养物可用于研究,以帮助更好地了解更真实的微环境中的细胞。细胞球在神经科学、再生医学以及癌症和心血管研究方面的应用非常有用。
挑战
当用细胞球做延时显微镜拍摄时,会出现某些挑战。由于实验可能持续数天、甚至数周,因此必须在保证接近生理条件的情况下,延长样品的存活时间。荧光标记物的表达必须保持在内源性水平,以防止损害细胞内稳态。
培养基中必须有稳定的营养物质供应和浓度不变的物质,否则这种物质的浓度可因蒸发而降低。长时间的正确成像要求显微镜成像保持聚焦,并适应不断变化的样品特征,如横向和轴向生长。
研究实验室可能没有涉及3D细胞培养的延时显微镜工作所需的仪器。这种情况下,通常通过在多个研究小组和用户间共享设施来解决,但这可能意味着在获得所需仪器之前需要漫长的等待时间。这些挑战可能会导致延迟获得重要的、可量化的结果,而这些结果将影响根本性突破和获得新的见解。
Mica介绍
MICA是全场景显微成像分析平台,它将研究人员需要的一切都统一在一个完全可控的、高度灵活的环境中,加速显微镜的工作流程,以便更快地获得有意义的科学结果。通过使用这个成像分析平台,您可以从以下方面受益: 人人皆享:轻松设置受控环境条件,匹配聚焦策略,并设置成像条件
机制简化工作流程:屏幕上注释和提取多个参数
触手可及:最佳的环境条件和多种成像模式(明场、宽场和共聚焦),以配合实验需要,以及水镜和聚焦策略的智能自动化
方法
这项长期延时研究是使用MICA来研究从稳定转染了MX1-GFP或 U343细胞开始的细胞球的形成。细胞球生长需要最佳的生理条件,确保细胞周期和增殖不受干扰[6,7]。
以往的研究结果表明,生长本身往往与特定的蛋白质或细胞状态和分化的某些标记物的表达相关[6,7]。
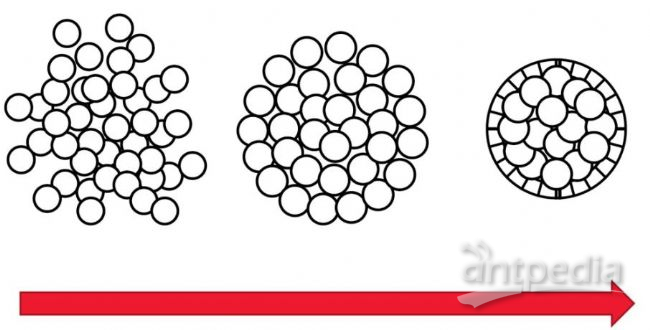
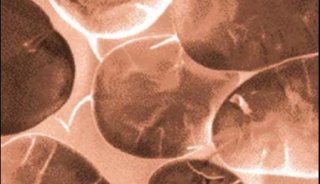
图1:图示细胞随时间而形成的细胞球。
MICA在这一关键应用中作为一种培养箱,在接近生理条件下维持3D细胞培养和细胞球,并最大限度地减少培养基蒸发。MICA可帮助用户测量细胞球的生长并分析蛋白质的表达水平。
图2和图3显示了在3D细胞球的形成及其生长的长期延时研究中获得的图像和数据。
视频 1:左半部分:稳定转染了MX1-GFP的MDCK细胞(整合调制反差IMC[灰色]和荧光[绿色]),右半部分:野生型U343细胞(整合调制反差[灰色])。圆底60孔多孔板间隔时间为30分钟拍摄72小时的延时视频。

图2:对60个孔随时间变化的分析:红色表示经过训练的像素分类器在60小时成像后的某个时间点检测到的区域。
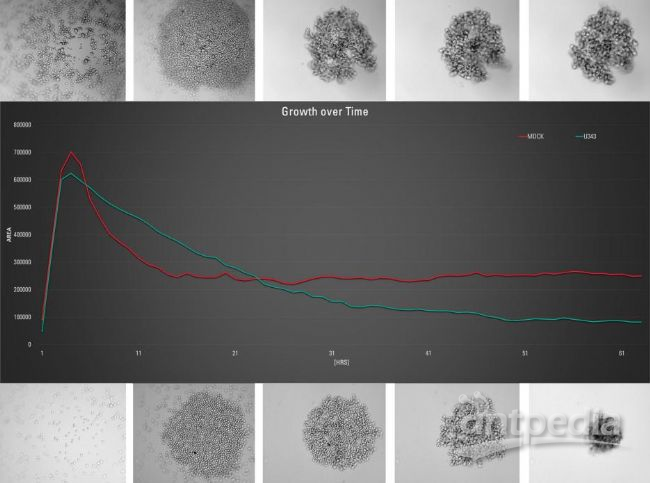
图3:上排:每孔1000个MDCK细胞形成3D细胞球的延时序列中选出的图像,其中细胞用MX1 GFP(绿色)稳定转染。这些图像分别是在接种细胞后第0、11、20、40和61小时的时间点拍摄的。图中所示的红色曲线是对形成的MDCK细胞球状体大小的相应测量。下排:每孔1000个U343细胞形成3D细胞球的延时序列中选出的图像。
这些图像也是在接种细胞后第0、11、20、40和61小时的时间点拍摄的。
图中所示的绿色曲线是对形成的U343细胞球体大小的相应测量。
了解更多:徕卡显微
参考资料
J.L. Collins, B. van Knippenberg, K. Ding, A.V. Kofman, Time-Lapse Microscopy, Ch. 3 in Cell Culture, Ed. R. Ali Mehanna (IntechOpen, London, 2018) ISBN: 978-1-78984-867-0, DOI: 10.5772/intechopen.81199.
Time-Lapse Microscopy: Technique and Significance, Looking at Cell Migration: What is Time-Lapse Microscopy (TLM)? Microscope Master.
Live-Cell Imaging Techniques Visualizing the Molecular Dynamics of Life, Science Lab (2022) Leica Microsystems.
T. Veitinger, Introduction to Live-Cell Imaging, Science Lab (2012) Leica Microsystems.
R.R. Shields-Cutler, G.A. Al-Ghalith, M. Yassour, D. Knights, SplinectomeR Enables Group Comparisons in Longitudinal Microbiome Studies, Front. Microbiol. (2018) vol. 9, DOI: 10.3389/fmicb.2018.00785.
N. Kalebic, P. Kanrai, J. Kulhei, Observing 3D Cell Cultures During Development, Science Lab (2021) Leica Microsystems.
S.S. Nazari, Generating 3D spheroids with encapsulating basement membranes for invasion studies, Curr. Protoc. Cell Biol. (2020) vol. 87, iss. 1, e105, DOI: 10.1002/cpcb.105.