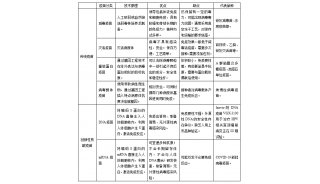
如何制备2亿剂mRNA疫苗:质量控制
本文节选自来自美国宾州大学的研究人员发表的文章“Manufacturing Strategy for the Production of 200 Million Sterile Doses of an mRNA Vaccine forCOVID-19”。

质量控制
确定mRNA产物的长度
在疫苗的最终制剂中应该出现的mRNA序列应该和设计的完全一致;序列应该包括5’帽、5’和3’ UTR、编码全长刺突蛋白的部分以及poly(A)尾。本方案中完整mRNA序列的长度正好为4,079个碱基。
必须有一个步骤来确定所生产的mRNA是全长的mRNA,以确保最高的翻译效率。为此,将从每个体外转录反应的产物中提取样本,并使用RNA凝胶电泳试剂盒对产物进行RNA凝胶电泳。在凝胶电泳过程中,带负电荷的mRNA向阳极移动。较短的RNA片段会比较长的RNA片段迁移得更远,所以这个过程可以用来确定体外转录反应的mRNA产物是否大部分是全长度的mRNA。凝胶应显示不少于90%的产物为全长mRNA。凝胶电泳结果如下图所示。另一种选择是对mRNA产物进行测序;不过,这种方法相对耗时且昂贵,凝胶电泳能够揭示想要的结果。

RNA凝胶电泳。条带代表特定长度的RNA。

生产过程模块示意图

mRNA生产过程整体工艺流程图
确定脂质纳米颗粒的粒径
确定脂质纳米颗粒(LNP)的粒径是非常重要的;为了使疫苗发挥最大效力,LNP大约需要达到80 nm。为了确定在我们的微流控设备中生产的LNP的大小,将使用动态光散射(DLS)技术。DLS使用散射光来确定给定颗粒的粒径。在微流控步骤过程中,将进行4次DLS分析。
检测内毒素水平
全球的大部分监管机构都要求生产的所有药品都要进行检测,以确定药品中的内毒素水平。革兰氏阴性菌具有内毒素,这些内毒素对人体毒性很大。为确保疫苗不受内毒素污染,在工艺过程的最后稀释步骤之后,将进行鲎变形细胞溶解物 (LAL) 检测。LAL检测法是一种标准的分析方法,被FDA认定有效,其可检测内毒素水平。因此,选择LAL法作为内毒素检测的方法。mRNA疫苗可接受的内毒素水平应小于10内毒素单位 (EU)/mL。
产品的包装和储存
经过最后的稀释和质量控制步骤后,产品将被包装成小瓶。每个2 mL玻璃瓶将包含0.45 mL的产品冷冻悬液。根据辉瑞目前的生产工艺,每个小瓶都使用溴丁基橡胶塞和铝密封件密封,铝密封件上有可翻转的塑料盖。小瓶将根据FDA法规的要求,以运输集装箱发送。每个集装箱将容纳5个托盘的疫苗,每个托盘容纳195瓶,相当于1,170剂。本方案的生产过程总共产生2亿剂,每周生产1,540万剂。这相当于每周生产200万瓶,每周2,100个集装箱。小瓶包装的过程将是机械工程策略的一部分,不属于本项目的范畴。
集装箱需要按照FDA规定进行储存和运输。如前文所述,疫苗将需要超低温冷冻冰箱 (-80℃至-60℃之间),冷冻冰箱(-25℃至-15℃之间)最多存放两周,冰箱(2℃至8℃之间)最多存放120小时/5天。
原文:I.Labarta, S.Hoffman, A.Simpkins, Manufacturing Strategy for the Production of 200 Million Sterile Doses of an mRNA Vaccine for COVID-19. 2021.