靶向蛋白质组学也进入4D时代了!!!

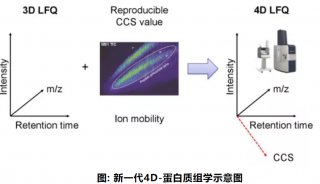
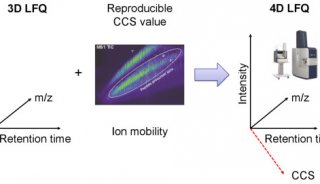
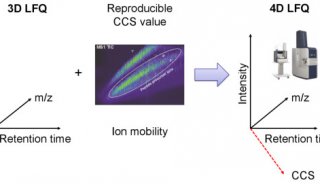
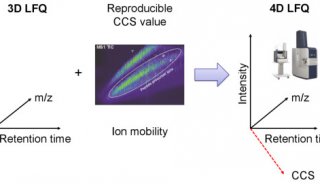
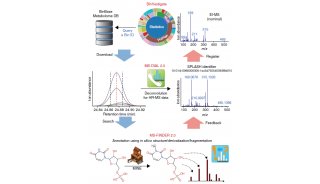
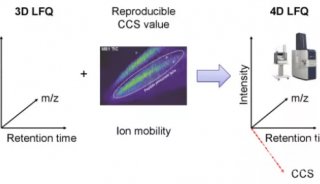
离子淌度概念的引入使得蛋白质组学进入了4D新时代。4D-蛋白质组学是在3D分离即保留时间(retention time)、质荷比(m/z)、离子强度(intensity)这三个维度的基础之上增加了第四个维度,离子淌度(mobility)(图1)。离子淌度的分离增加了肽段离子的选择性,提高谱图专属性,进而大幅提升prm-PASEF的定量准确性(图2)。近期,卢森堡大学蛋白质组平台Antoine Lesur教授及Gunnar Dittmar教授在《Expert Review of Proteomics》中发表了“The clinical potential of prm-PASEF mass spectrometry”,阐述了PASEF模式下带来的高灵敏度及高扫描速度,使prm-PASEF成为了分析生物基质的理想模式,展现在临床应用上的巨大潜力。
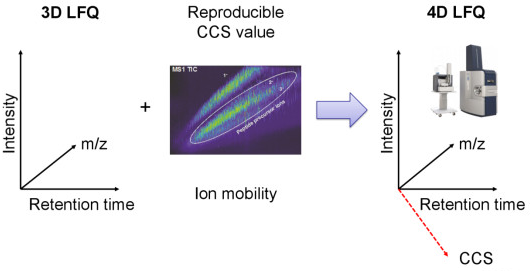
图1. 新一代4D-蛋白质组学示意图
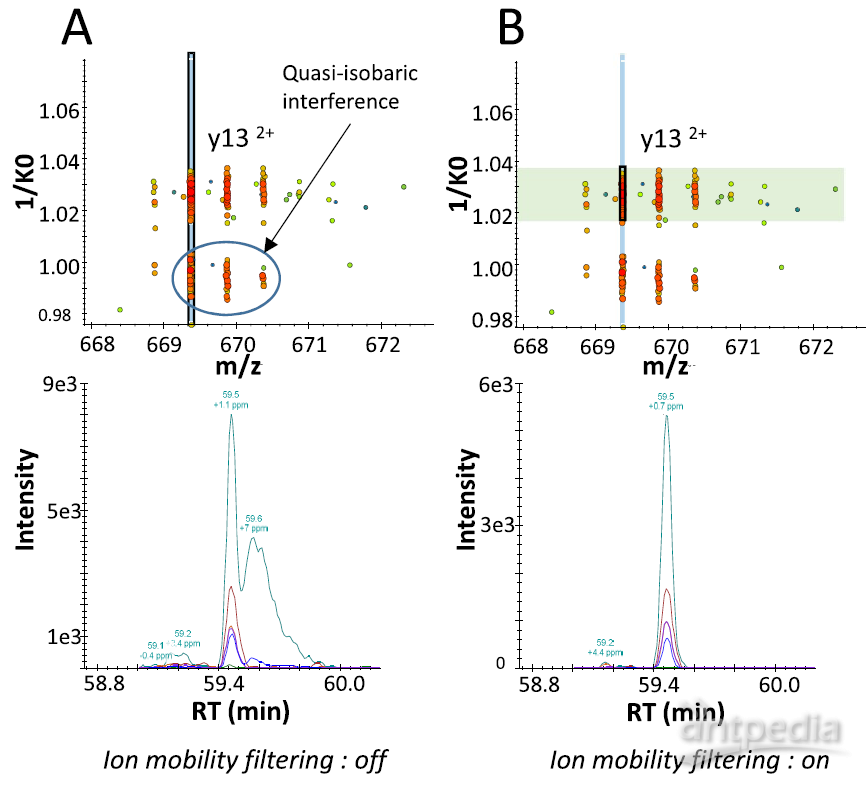
图2. prm加入离子淌度分离,提高离子选择性
靶向组学发展进程:从SRM到PRM再到PASEF-PRM
过去使用三重四极杆进行SRM采集,SRM主要是透过第一个四极杆筛选特定的m/z,在第二个四极杆中进行碰撞碎裂,最后在第三个四极杆进行质量分析。此模式具有灵敏度高及动态范围广等优势,但因受三重四极杆较低的分辨率影响,使其在选择性上大受限制,因此在SRM的方法建立及确效上往往需要耗费大量时间。因此限制,四极杆与高分辨质谱仪的串联发展出了平行反应监测(PRM)采集模式,其优势为,在高频率采集下,一次MS/MS的采集中能记录母离子击碎后所有的碎片离子信息,并可进行后续的定量分析(图3)。PRM方法已经成为靶向蛋白质组学数据采集的主流方法,通过对特异性肽段或目标肽段(如发生翻译后修饰的肽段)进行选择性检测,从而实现对目标蛋白质/修饰肽段的靶向相对或绝对定量。
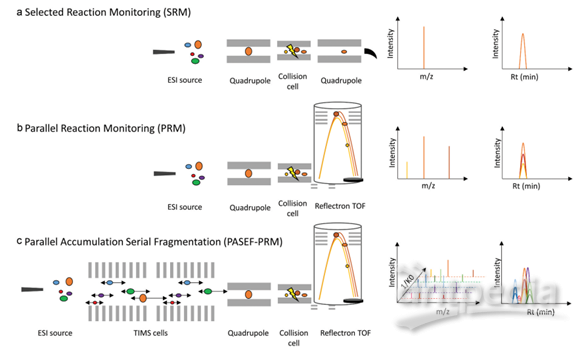
图3. SRM, PRM, PASEF-PRM 采集模式统整
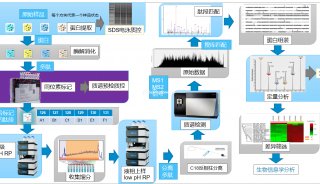
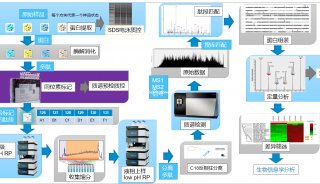
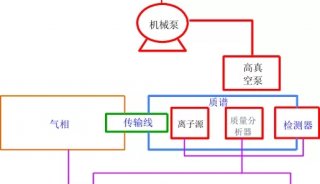
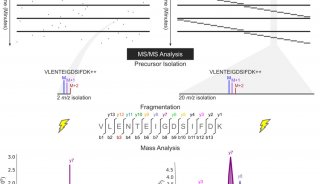
最近离子淌度的加入,并由此发展出的4D-PRM方法prm-PASEF,进一步提升了PRM的分析通量和结果可靠性。离子淌度的分离主要是通过肽段离子间在碰撞截面积及带电荷上的差异,使得电场驱动下离子在气体阻挠环境中的迁移速率差异进行分离。布鲁克timsTOF Pro的模块设计,可使离子在TIMS淌度分析器内同时进行离子捕集及离子淌度分离。而PASEF采集模式则是同步联动后端四极杆进行母离子的选择及传输,达到离子利用率100%及采集速度快等优势。在prm-PASEF模式中,是通过保留时间、m/z和淌度值选定靶向肽段的并进行二级采集(图4),prm-PASEF可对靶向离子进行高分辨率的二级扫描,取得的数据也可通过提取离子色谱图及峰积分进行后续处理。
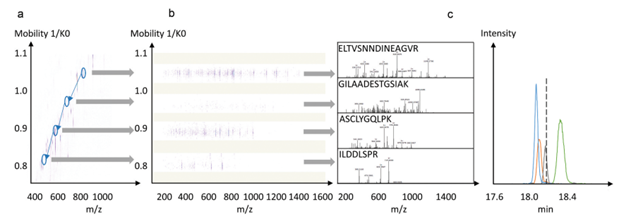
图4. prm-PASEF采集模式原理
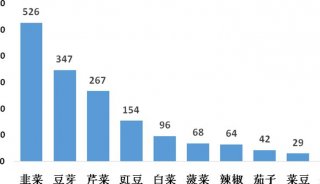
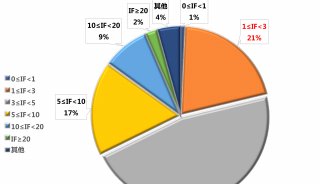
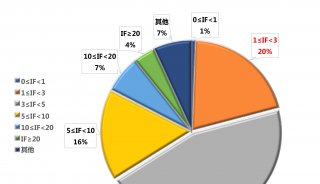
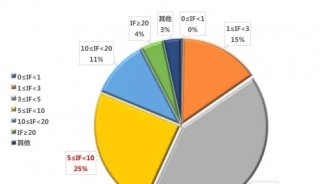
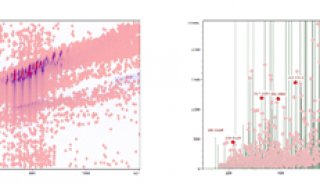
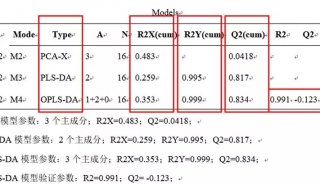
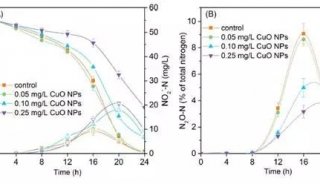
prm-PASEF模式中,隔离窗口的设置主要与色谱与离子淌度的重现性与分辨率相关。作者以在20分钟的色谱梯度内,监测370个目标肽段为例(样本为胰蛋白酶进行酶切的人类K-562细胞)(图5),平均每个MS cycle内为8.3个PASEF frame(最多为13个),而每个PASEF frame内,至多可监测10条肽段,将每个峰可取得的数据点数进行统计,其中位数为15,此数值可对后续定量进行精准分析(三针技术性重复的相对标准偏差中位数为3%)。
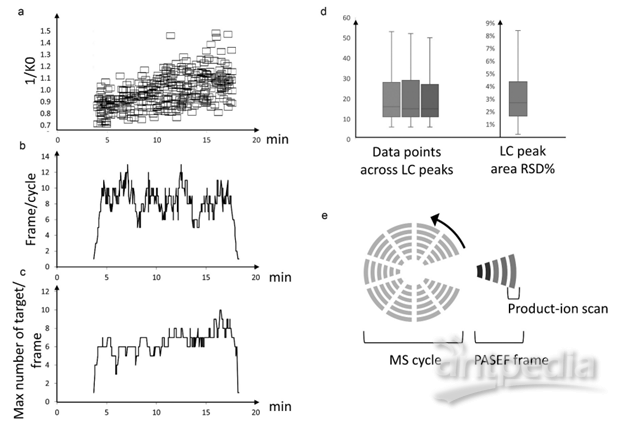
图5. 使用20分钟的色谱梯度,检测370个目标肽段(样本为胰蛋白酶消化的人类K-562细胞)的相关数据展示
靶向蛋白组学工作流程
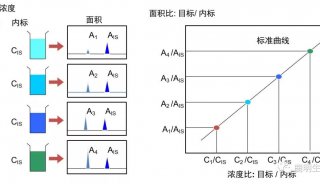
prm-PASEF方法的建立需订定出一个具单一序列的肽段列表,而非蛋白列表,去进行定量,而最理想的情况为先对样本进行DDA-PASEF的采集,再从中进行相关肽段的选择,而后合成对应的重标肽。prm-PASEF方法建立的相关重要参数包含色谱分离的保留时间、肽段离子的电荷数及离子淌度值,灵敏度则可以透过碰撞能量去进行优化。增加的离子淌度维度,使得timsTOF Pro上搭载的挥发性校正液可进行自动校正,色谱柱的柱效等可以透过峰强度、峰宽与保留时间的改变体现,最后,数据处理可通过特定软件(如:skyline)进行,定量结果可经由内源性肽段与重标肽的峰面积比值计算而得(图6)。
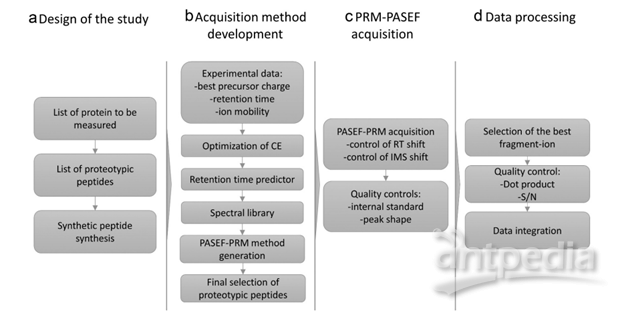
图6. prm-PASEF工作流程
prm-PASEF的临床应用潜力
过去病理学的临床诊断通常基于DNA或RNA的诊断测试、组织切片染色或是ELISA这类抗原-抗体检测系统进行分析,相较于组织切片染色及ELISA主要为蛋白层面的分析,PCR则是用来揭示基因层面的变化或转录组的紊乱。PCR可准确侦测突变,但基因和蛋白表达间相关性的变化仍是诊断中常见的问题,而透过靶向蛋白质组学可以解决此问题,选择性地去监测氨基酸交换可对突变蛋白进行定量分析,而只有使用特异性极高且低交叉反应性的抗体对一般蛋白进行反应,ELISA或组织切片染色才有可能达到同样的诊断结果。也正因为靶向蛋白组学的高灵敏度与高定量准确度,且不同于抗体诊断需考量抗原干扰、批次差异、保存问题等,使靶向蛋白组学成为极为重要的诊断工具之一。
作者的实验结果展现prm-PASEF的超高灵敏度及高母离子选择通量,使其成为分析生物基质的理想模式,在去了14个高丰度蛋白并胰蛋白酶进行酶切的人类血清样本中,最低定量极限(LOQ)可低至5.5amol/uL,其对应浓度为0.2ng/mL 的35kDa蛋白,结果亦展现良好的线性(图7)。
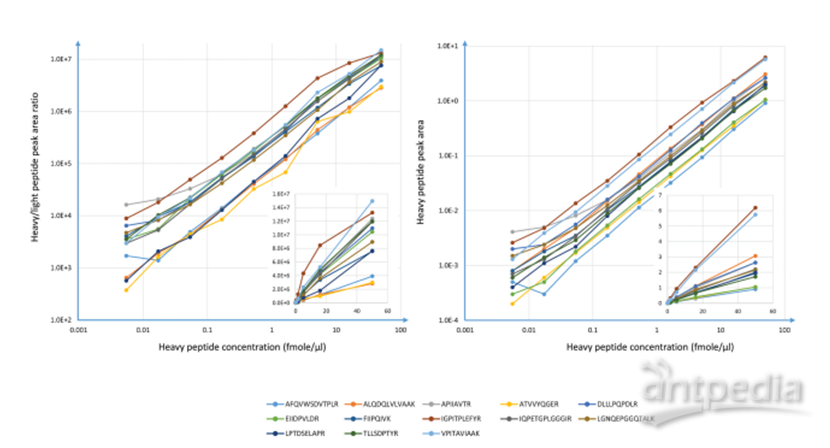
图7. prm-PASEF分析人类血清样本的线性结果
SRM到PRM的进展,为靶向蛋白组学带来了灵敏度及准确度的提升,与此同时,prm-PASEF在TIMS离子淌度内对离子进行累积并释放的工作模式,更使灵敏度获得显著性的提升,且大幅地提高了母离子的选择通量,有助于在同一时间内分析多个临床样本中的生物标志物,高母离子选择通量也使分析时长大幅缩短,对于时常需要面对大队列样本及样本量少的临床研究相关分析,prm-PASEF无疑具有极大的优势。
参考文献:
Antoine Lesur, et al., The clinical potential of prm-PASEF mass spectrometry, Expert Review of Proteomics, 2021, 18, 75-82
Antoine Lesur, et al., Highly Multiplexed Targeted Proteomics Acquisition on aTIMSQTOF, Analytical Chemistry,2021, 93, 1383-1392
Bruno Domon, et al., Recent advances in targeted proteomics for clinicalapplications, Proteomics ClinicalApplications, 2015, 9, 423-431
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章
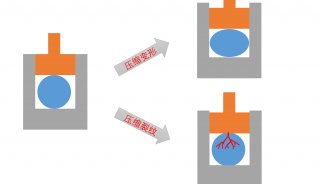
-
厂商文章

-
厂商文章
-
厂商文章
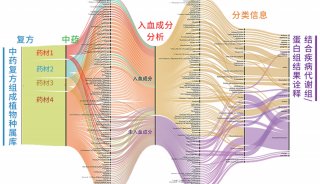
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
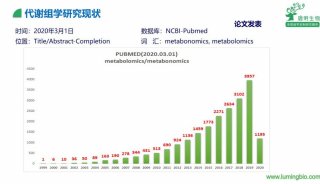
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
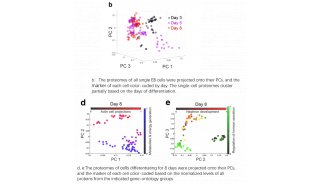
-
厂商文章

-
厂商文章

-
厂商文章
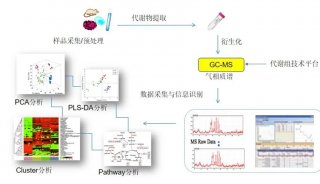
-
厂商文章
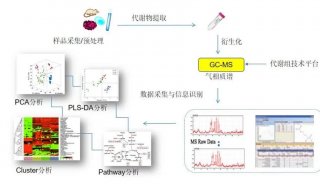
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章








