绘谱导读 | 2021年12月代谢组学文献精选
导读目录
1. Brain丨肠道细菌产生的神经毒性代谢物或加剧多发性硬化疾病
2. Gut Microbes | 小檗碱联合益生菌治疗是改善2型糖尿病患者餐后高脂血症的有效方案
3. Nature Communications | 从癌前病变到侵袭性肺腺癌的进化代谢图景
4. Clin. Transl. Med. | TRIM11对AMPK活性的抑制促进代谢应激下肝细胞癌的细胞生存
5. Cell Metabolism | NEAT1对于促进乳腺癌生长和转移的代谢变化至关重要
6. Nature | 一种代谢长链烷烃产生甲烷的古细菌
7. Nature Communications | 雄激素驱动的肠道菌群参与糖代谢性别差异形成
8. Cell Metabolism | 谷氨酸代谢重塑能量分配以调节宿主-病原体易感性
9. Cell Death and Disease | 胃癌中微生物群与代谢物的相互作用
10. Nature | 组合、相加和剂量依赖性药物-微生物组关联
第一篇:Brain丨肠道细菌产生的神经毒性代谢物或加剧多发性硬化疾病

神经或精神性疾病患者的肠道菌群失紊乱强调了肠-脑轴交流对大脑健康的影响,此前研究发现,用富马酸二甲酯(DMF)治疗复发缓解型多发性硬化(RRMS)的作用可能与肠道菌群的变化有关。本研究分析了DMF治疗前后RRMS患者的样本和临床数据,从患者血液和脑脊液中鉴定出肠道细菌源神经毒性代谢物,并揭示了其作用机制。
1. 将大鼠神经元暴露于RRMS患者用DMF治疗前后的脑脊液(CSF)样本中,评估队列中是否存在肠道细菌产生的神经毒性代谢物,而经DMF治疗后,RRMS患者CSF神经毒性降低。
2. 对基线和治疗后的血浆和CSF样本进行代谢组学分析,鉴定到多种细菌产生的苯酚和吲哚类代谢物具有潜在神经毒性,包括硫酸对甲酚、硫酸吲哚酚、N-苯乙酰谷氨酰胺,而且在治疗过程,这些代谢物逐渐减少。
3. 上述物质可能通过血液和脑脊液到达中枢神经系统,进而接触浅皮质层的神经元,诱导轴突损伤和神经元功能障碍,其神经毒性与线粒体功能障碍和氧化应激无关。
4. 这些细菌代谢物(硫酸对甲酚、硫酸吲哚酚、N-苯乙酰谷氨酰胺)水平与MRI皮层体积指标呈负相关,与神经丝轻链(神经退行性病变的生物标志物)水平直接相关。

Bacterial neurotoxic metabolites in multiple sclerosis cerebrospinal fluid and plasma. Brain. 2021.
原文阅读,请识别下方二维码

第二篇:Gut Microbes | 小檗碱联合益生菌治疗是改善2型糖尿病患者餐后高脂血症的有效方案

非空腹血脂异常(nFL)主要由餐后脂血症(PL)引起,最近被认为是一种重要的心血管疾病(CVD)风险,PL是T2D患者血脂异常的共同特征。本研究是一项随机、安慰剂对照和多中心临床试验,旨在评估益生菌(Prob)和小檗碱(BBR)联合治疗通过改变肠道菌群抗糖尿病和降血脂,能否有效降低T2D中的PL,并探讨其潜在机制,发现BBR和Prob(B.breve)对PL具有协同降血脂作用,作为肠道脂质库,实现T2D中更好的血脂和CVD风险控制。
1. 研究者检测了365名T2D患者的血液PL,在3个月的随访,Prob+BBR在改善餐后胆固醇(pTC)和低密度脂蛋白胆固醇(pLDLc)水平方面优于单独BBR或Prob,且餐后多种脂质组代谢物(FFAs和磷酯类)减少。
2. 联合治疗在改善PL和餐后脂质代谢谱方面的优越效应,可能与单独使用BBR或Prob+BBR处理后粪便Bifidobacterium breve水平的变化有关。
3. 在B. breve基因组中共鉴定出4个编码长链酰基辅酶A合成酶的fadD基因,并被BBR转录激活;与对照组相比,体外BBR处理进一步降低了B. breve培养基中FFA的浓度。因此,BBR对fadD的激活可以增强B. breve的FFA输入和动员,并通过稀释腔内脂质的吸收,介导Prob+BBR对PL的影响。

Combined berberine and probiotic treatment as an effective regimen for improving postprandial hyperlipidemia in type 2 diabetes patients: a double blinded placebo controlled randomized study. Gut Microbes. 2022.
原文阅读,请识别下方二维码

第三篇:Nature Communications | 从癌前病变到侵袭性肺腺癌的进化代谢图景

在过去的十年中,代谢组学分析极大地扩展了我们对代谢的认识,并揭示了癌症发展过程中的代谢变化。代谢重编程在多种癌症发生和发展过程中均起一定作用,但是针对肺癌的癌前病变发展到肺腺癌(LUAD)的代谢进展还不十分明确。本研究利用靶向代谢组学临床样本检测描绘了从癌前病变到LUAD发展过程中代谢进展的综合图景。
1. 研究者针对一个队列的肿瘤和邻近正常组织以及另一个患者队列的动态血清样本,分别进行靶向液相色谱-质谱(LC-MS)代谢组学分析,结果显示在肿瘤早期阶段,嘌呤和嘧啶代谢、硫胺素代谢和甘油磷脂代谢均表现出显著异常。半胱氨酸和蛋氨酸代谢途径中的产物随着肿瘤进展产生显著变化。
2. 血浆代谢谱,在4个阶段共鉴定出16种差异性代谢物,包含4种代谢物的标志物组,包括3-氯酪氨酸、12:0肉毒碱、谷氨酸盐和胆碱磷脂,AUC值为0.894,有助于识别良性病变和LUAD。
3. 利用代谢组学聚类分析定义了具有显著临床特征的IAC患者的三种代谢亚型,其中预后较差的III型胆汁酸代谢异常与不良临床特征相关,其中CA、GCDCA、TCDCA和GCA胆汁酸的水平与临床结局高度相关。
4. 后续TGR5基因敲除动物实验证明了异常胆汁酸代谢可能促进LUAD的转移,这可作为潜在的易感靶点和用于患者分层,也可能成为改善III型预后差的潜在治疗靶点。
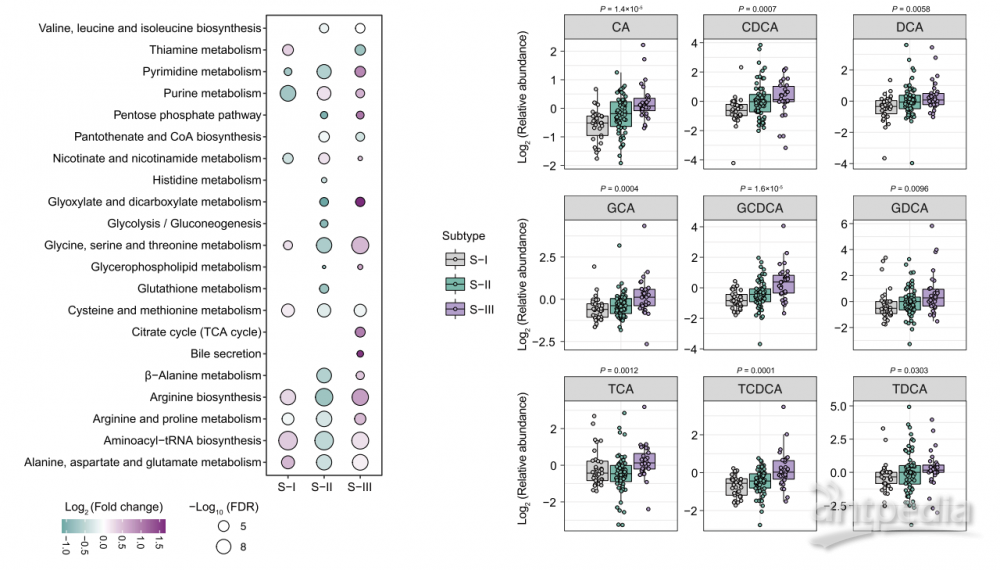
三种亚型的代谢差异及胆汁酸变化
Evolutionary metabolic landscape from preneoplasia to invasive lung adenocarcinoma. Nature Communication. 2021.
原文阅读,请识别下方二维码

第四篇:Clin. Transl. Med. | TRIM11对AMPK活性的抑制促进代谢应激下肝细胞癌的细胞生存

在代谢应激期间, AMPK是保持细胞能量平衡的主要传感器。在多种人类癌症中都检测到AMPK的缺失或其活性的失调。然而AMPK活性失调的潜在分子机制仍不清楚。本研究发现了泛素连接酶TRIM11可以通过抑制能量感受器AMPK的活性,进而促进肝癌在代谢应激环境下存活与生长。
1. 首先发现TRIM11可以调节肝癌细胞和患者组织中的糖代谢。TRIM11的上调是一种新的保护机制,可避免HCC细胞在代谢应激下死亡。TRIM11通过直接促进AMPKβ2的蛋白质降解来破坏AMPKβ2的稳定性,这是其影响AMPK活性和HCC细胞存活所必需的。
2. 分析自噬激活呈负相关肝癌组织中TRIM11水平的表达,其在代谢应激期间负性调节自噬诱导自噬,自噬通量抑制剂氯喹(CQ)可有效抑制TRIM11介导的自噬激活,认为TRIM11通过控制AMPK活性负性调节自噬。
3. 接着探讨了AMPK活性是否是TRIM11介导的肝癌细胞存活保护所必需的。发现抑制TRIM11-AMPK轴有助于肝癌的有效治疗,TRIM11的表达水平与AMPKβ2和pAMPK呈负相关。TRIM11的上调可促进肿瘤进展,并可作为泛癌队列预后不良的重要指标。
4. 本文揭示了TRIM11是调控代谢应激环境的一个关键“启动子”,TRIM11-AMPK功能轴对于肝癌在代谢应激下的发生发展至关重要,这为肝癌临床治疗提供新的干预靶点。
Inhibition of AMPK activity by TRIM11 facilitates cell survival of hepatocellular carcinoma under metabolic stress. Clin. Transl. Med. 2021.
原文阅读,请识别下方二维码

第五篇:Cell Metabolism | NEAT1对于促进乳腺癌生长和转移的代谢变化至关重要

长链非编码RNA (lncRNAs)可以通过控制代谢酶和转运体的表达或通过调节信号通路来调节葡萄糖代谢。NEAT1 (Nuclear abundant transcript 1 )是一种高度丰富的lncRNA,然而NEAT1在肿瘤进展中参与糖代谢的分子机制尚不清楚。本文报道了NEAT1在乳腺癌中促进糖酵解状态的作用,强调了lncRNAs如何在体内代谢水平上调控癌症的进展。
1. 作者采用MMTV-PyVT(小鼠乳腺肿瘤病毒-多瘤病毒中间T抗原)小鼠,发现缺失NEAT1会严重损害肿瘤起始、生长和转移,特别是关闭糖酵解的倒数第二步;
2. 检测乳腺PyVT肿瘤的代谢途径,在糖酵解代谢产物如3-磷酸甘油酸(3-PG)/2-磷酸甘油酸(2-PG)和磷酸烯醇丙酮酸(PEP)、丙酮酸和乳酸显著降低,而上游的葡萄糖、葡萄糖-6-磷酸(G-6-P)/果糖-6-磷酸(F-6-P)和甘油醛-3-磷酸(GA-3-P)却因NEAT1缺失而显著升高,并采用qRT-PCR验证乳腺癌患者中NEAT1上调;
3. 在机制上,NEAT1直接结合并形成了PGK1/PGAM1/ENO1复合物组装的支架桥,从而促进了底物通道的高效糖酵解,葡萄糖和谷氨酰胺的剥夺、敲低PGK1、PGAM1和ENO1或相应酶抑制剂均可阻断倒数第二糖酵解进而阻碍NEAT1驱动的肿瘤发生;
4. 最后作者证明Pinin介导葡萄糖刺激的NEAT1的核输出,且NEAT1_1亚型是有效的乳腺肿瘤生长和糖酵解诱导物,通过它发挥异构体特异性和不依赖于旁斑点的功能促进糖酵解和癌症进展,建立了NEAT1在调节肿瘤代谢中的直接作用,为Warburg效应提供了新的见解。

NEAT1 is essential for metabolic changes that promote breast cancer growth and metastasis. Cell Metabolism. 2021.
原文阅读,请识别下方二维码

第六篇:Nature | 一种代谢长链烷烃产生甲烷的古细菌

石油烃的产甲烷降解可通过烃降解菌和产甲烷古菌的共生伙伴关系进行。最近研究表明古生菌“甲醇假丝酵母”单独可以将长链烷烃的降解与产甲烷作用结合起来。本研究利用稳定同位素碳标记培养实验结合宏基因组学、宏转录组学和高分辨质谱等技术解析新型产甲烷古菌(Candidatus Methanoliparum),首次证实了其独立降解长链烷基烃产甲烷的功能。
1. 作者取胜利油田地下油藏的缺氧油泥与不含硫酸盐的缺氧矿物培养基共培养发现微生物明显生长,消耗链长在13-38个碳原子之间的正构烷烃、烷基取代环己烷和正烷基苯并产生甲烷,进行16S rRNA 基因测序发现Ca. Methanoliparia约占所有古细菌的49%。
2. 分子分析发现Ca. Methanoliparum含有过表达烷基辅酶M还原酶和甲基辅酶M还原酶的基因,它们是古生多碳烷烃和甲烷代谢的标志基因,用不同底物孵育实验和对辅酶-M结合中间体进行质谱检测证实,Ca. Methanoliparum不仅能在多种长链烷烃上生长,而且能在正烷基环己烷和长烷基苯(C >13)上生长。
3. 利用扩增子测序、宏基因组学和元转录组学研究Ca. Methanoliparum在十六烷降解培养中的功能,培养物中检索到47个Ca. Methanoliparum MAGs,其中Ca. M. thermophilum既能降解十六烷,又能生成甲烷。
4. Ca. Methanoliparum产甲烷古菌可以直接氧化长链烷基烃,并通过β-氧化、Wood-Ljungdahl途径进入产甲烷代谢,而不需要通过互营代谢来完成。

Non-syntrophic methanogenic hydrocarbon degradation by an archaeal species. Nature. 2021.
原文阅读,请识别下方二维码

(提取码:0ifb)
第七篇:Nature Communications | 雄激素驱动的肠道菌群参与糖代谢性别差异形成

流行病学研究表明,男性通常比女性更容易受到葡萄糖代谢受损和 2 型糖尿病 (T2D) 的影响。在人类和啮齿类动物中普遍观察到性别依赖性葡萄糖代谢差异。然而潜在的机制尚不清楚。本研究发现肠道微生物组的缺失消除了葡萄糖代谢中的性别二型性,确定雄激素在葡萄糖稳态恶化中的作用,为靶向菌群来改善T2D(特别是在男性中)提供了新思路。
1. 16S rRNA 基因测序揭示正常雄性和雌性成年小鼠之间的肠道菌群组成差异。雄性小鼠的葡萄糖耐量比雌性差,用抗生素(ABX)处理耗竭肠道菌群可消除正常小鼠的糖代谢上的性别差异(改善雄鼠代谢)。
2. 检测接受或不接受 ABX 处理的 高脂喂养(HFD) 小鼠的肠道菌群和代谢变化,同样地,HFD 雄性小鼠与雌性小鼠的肠道菌群不同,且前者葡萄糖耐量和胰岛素敏感性受损,空腹胰岛素水平高于雌性,在 ABX 处理后改善至与雌性小鼠相当的水平。
3. 将雄鼠菌群移植给ABX雌鼠可改善雌鼠的胰岛素抵抗;对雄鼠阉割后,其菌群特征与雌鼠接近,并改善其糖代谢;而重新引入雄激素——双氢睾酮 (DHT)则会逆转这些变化,而ABX处理可消除雄激素对糖代谢的影响。
4. 机制上,雄激素通过肠道菌群降低血液谷氨酰胺(Gln)水平以及Gln/谷氨酸(Glu)比值;细胞实验也表明,补充谷氨酰胺可增加体外胰岛素敏感性;临床上,血清Gln/Glu比值与胰岛素敏感性和雄激素相关。

Sexual dimorphism in glucose metabolism is shaped by androgen-driven gut microbiome. Nature Communications. 2021.
原文阅读,请识别下方二维码

第八篇:Cell Metabolism | 谷氨酸代谢重塑能量分配以调节宿主-病原体易感性

同一种群内的宿主通常在对相同传染源的易感性方面表现出个体差异,突出了免疫代谢反应的异质性。然而形成这些差异的潜在免疫代谢机制尚不清楚。
1. 本研究利用果蝇模型,分析果蝇感染铜绿假单胞菌 (P.e.) 后,果蝇种群中个体果蝇的宿主感染结果和宿主代谢的表型变异,结果显示,宿主感染结果的表型变异与宿主能量底物资源分配的变化相关。
2. 肌内核因子-κB(NF-κB)信号的激活强度调控宿主能量底物的重新分配以改变宿主-病原体的易感性;使用胸肌转录组学来探讨当NF-κB 信号在肌肉中遗传减弱时基因表达网络中独特的感染介导的变化,结果显示,肌内线粒体动力学的变化与种群内宿主感染结果的表型变异相关。
3. 调节线粒体动力学的生活史事件可以控制种群内宿主-病原体反应的表型变化,可能是通过改变宿主能量底物重新分配和能量平衡的组织间代谢反应。
4. NF-kB可以直接结合谷氨酸脱氢酶 (Gdh) 的启动子并限制肌肉感染P.e.后 Gdh 转录的诱导性,肌肉和线粒体衍生的谷氨酸很可能作为一种全身代谢物来传达宿主内感染介导的能量底物需求(肌肉-脂肪轴)。
5. 谷氨酸调节脂肪组织中钠依赖性多种维生素转运蛋白(Smvt)介导的维生素代谢,以直接重新分配宿主能量底物并改变宿主病原体易感性。
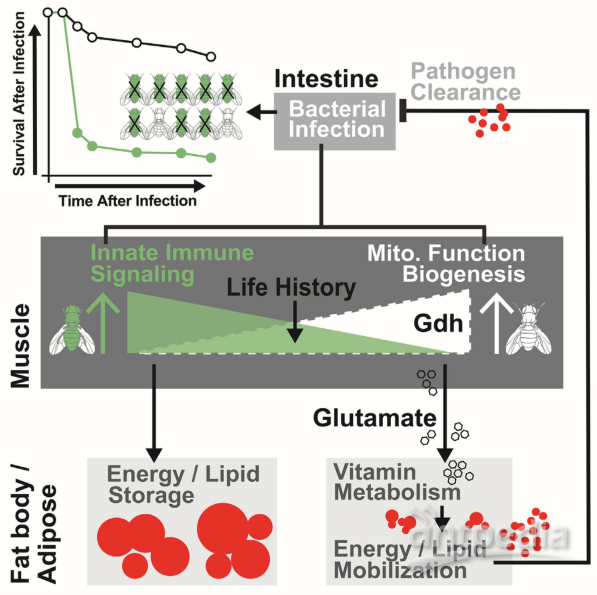
Glutamate metabolism directs energetic trade-offs to shape host-pathogen susceptibility in Drosophila. Cell Metabolism. 2021.
原文阅读,请识别下方二维码

第九篇:Cell Death and Disease | 胃癌中微生物群与代谢物的相互作用

既往的研究发现胃部肿瘤组织中的细菌多样性和丰富度低于非肿瘤组织,且不同胃微生境中微生物群的组成发生显著改变。肿瘤的发展不仅受到微生物群的影响,还受到其代谢物的影响。然而,微生物对GC组织中代谢物生产和降解的贡献仍不清楚。本研究通过多组学分析发现GC肿瘤组织和正常组织之间代谢组谱的差异可能部分是由于微生物的集体活动,并最终影响了胃癌的发生和进展。
1. 招募37例GC肿瘤组织和匹配的非肿瘤组织进行16s rRNA基因测序。结果显示GC肿瘤组织的微生物多样性和丰富度高于非肿瘤组织。非肿瘤组织中幽门螺杆菌的丰度增加,而肿瘤组织中乳酸杆菌、链球菌、类杆菌、普氏杆菌和另外6个属的丰度增加。
2. 分析(1)中组织的非靶向代谢组谱,共筛选到150种显著差异代谢物,其中氨基酸、碳水化合物和碳水化合物结合物、甘油磷脂和核苷酸的相对丰度在肿瘤组织中高于非肿瘤组织。
3. 进一步分析表明,1-甲基烟酰胺和 N-乙酰-D-氨基葡萄糖-6-磷酸的组合可以作为区分 GC 肿瘤和非肿瘤组织的有力生物标志物。
4. 相关分析表明,幽门螺杆菌和乳酸杆菌分别与氨基酸、碳水化合物、核苷、核苷酸和甘油磷脂类的大多数差异代谢物呈负相关和正相关,幽门螺杆菌和乳酸杆菌可能分别在这些类别的大多数差异代谢物的降解和合成中发挥作用。
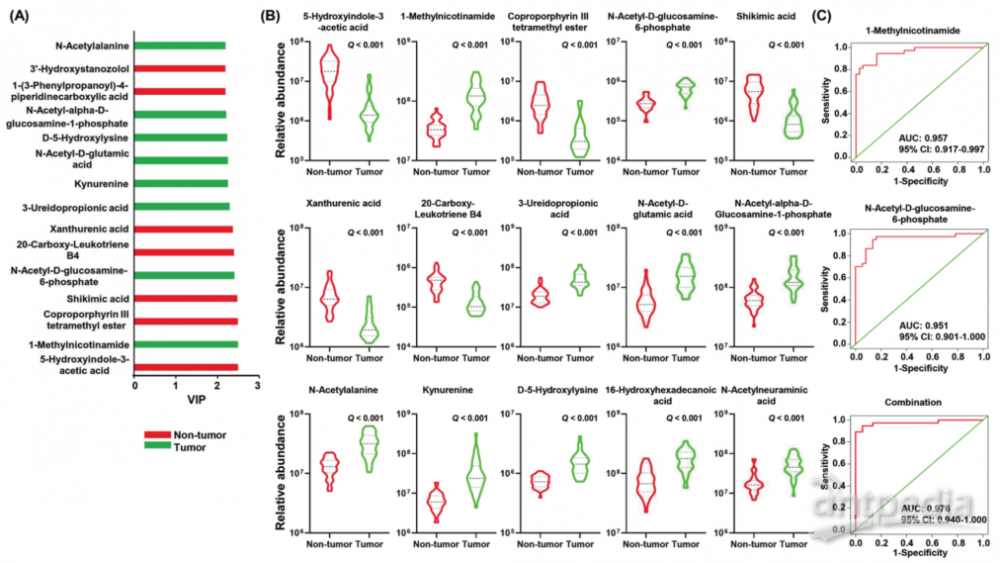
Interactions between gastric microbiota and metabolites in gastric cancer. Cell Death and Disease. 2021.
原文阅读,请识别下方二维码

第十篇:Nature | 组合、相加和剂量依赖性药物-微生物组关联

目前已有临床研究发现有些药物对于肠道微生物组的影响明显大于宿主疾病本身。在体外已经证明了药物与微生物直接的相互作用。在疾病背景中全面了解解析药物与微生物之间的关系,尚缺少大样本的研究。本研究利用大量临床样本解开了多种药物对于肠道微生物群和血清代谢组的影响,为将来利用药物的肠道调节能力以实现个性化治疗打下基础。
1. 对来自MetaCardis队列的2173名欧洲居民进行综合多组学分析,发现相比疾病而言,药物对宿主和肠道菌群特征的变异影响更大。
2. 量化了单一药物及其组合的推断效应以及加性效应,并表明后者使代谢组和微生物组向更健康的状态转变,例如他汀类药物联合阿司匹林或阿司匹林协同,降低血清致动脉粥样硬化脂蛋白药物组合以及相加效应,相比单一药物的作用,更能够将代谢组和微生物组向更健康的状态转变。
3. 分析了心脏代谢药物剂量、临床标记物和微生物组组成的改善之间的关系,这些都支持药物的直接效应。利尿剂与β受体阻滞剂联合使用可使肠道玫瑰杆菌富集。
4. 本研究的分析方法能够在接受多重药物治疗的个体中解释药物和疾病对宿主和微生物群特征的影响,这一框架为心脏代谢疾病中的药物宿主-微生物群系相互作用提供了新的假设。

Combinatorial, additive and dose-dependent drug-microbiome associations. Nature. 2021.
原文阅读,请识别下方二维码


-
仪器推荐
-
仪器推荐

-
仪器推荐
-
仪器推荐

-
仪器推荐

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章