组织中蛋白质大分子的MALDI质谱成像分析

作为生命的物质基础之一,蛋白质在催化生命体内各种反应进行、调节代谢、抵御外来入侵以及控制遗传信息等方面都起着关键的作用。近年来,MALDI质谱成像作为一种无需标记的新型的成像技术,被广泛应用于蛋白质研究。相比于传统的蛋白组学、免疫组化等方法,它可以直接从生物组织切片表面获得特异的几十种到几百种蛋白质分子的空间分布的精确信息, 构建蛋白质在细胞或组织中的“结构、空间与时间分布”网络。
目前,蛋白质的MALDI质谱成像主要有两种研究方法:1)Bottom-up策略用于分析蛋白质酶解后的多肽片段从而实现蛋白质鉴定;2) Top-down策略用于直接分析完整蛋白质。在Bottom-up中,需要先将组织切片上的蛋白质进行原位酶解,再利用MSI检测酶解后的多肽片段,进而获得切片表面蛋白质的分布信息,原位酶解法的应用范围较广,所检测的蛋白质分子量没有上限;而Top-down策略可直接在组织表面检测完整蛋白质,但利用该方法检测的质量范围较窄,并受灵敏度限制,一般适用于检测分子量小于25kDa的蛋白质。
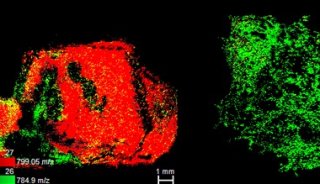
范德堡大学的Richard Caprioli实验室基于布鲁克ultrafleX II MALDI-TOF/TOF研究了鼠脑切片中蛋白质的空间分布情况,并对检测到的蛋白质进行了鉴定[1],实验流程如图1所示:首先将鼠脑制备成12µm厚度的冷冻切片,然后将组织附着在ITO导电载玻片的导电表面,放置于真空干燥器中抽真空30min,再将组织用90%乙醇、9%冰醋酸和1%去离子水的混合溶液清洗30s,以除去组织表面的盐和高含量的脂质, 将有机溶剂冲洗后的组织在干燥器中抽真空后,利用基质喷雾仪在组织上均匀喷涂上0.083µg/µL的胰蛋白酶溶液,然后在21℃的室温下孵育4h,孵育结束后喷涂25mg/mL DHB基质溶液, 进行成像数据采集。根据采集的多肽成像数据,选取高强度的母离子进行MS/MS实验,将MS/MS谱图在Mascot中进行数据库搜索,从而实现组织中蛋白质的原位鉴定。同时,在整个实验过程中,作者还结合了Top-down策略对鉴定出的蛋白质进行验证,将另一块相邻的鼠脑切片用相同的有机溶剂清洗后喷涂上15mg/mL SA基质溶液,直接在MALDI TOF质谱仪上进行蛋白成像数据采集。通过对比完整蛋白和酶解后多肽片段的离子热图,可以充分验证蛋白鉴定结果的正确性,实验成功得到了PEG-19、神经粒蛋白和髓鞘碱性蛋白等在鼠脑切片的空间分布信息。
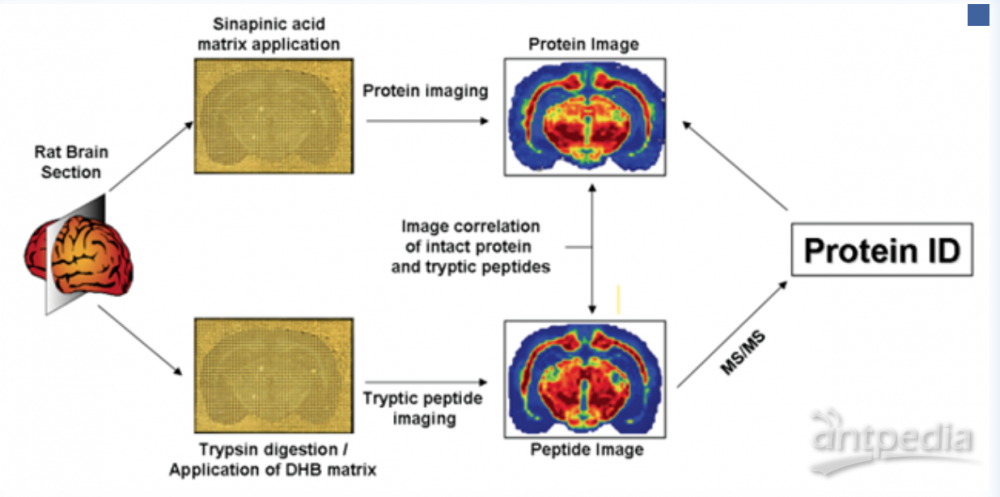
图1:蛋白质大分子质谱成像工作流程
MALDI 质谱成像中的蛋白质鉴定对于帮助理解生物分子和细胞系统的生理作用至关重要。但是,由于MALDI产生的离子通常为低价电荷状态,大大降低了它们的气相碎裂效率,因此使得直接从组织中进行蛋白鉴定变得困难[2]。蛋白质的鉴定需在有效空间分辨率和灵敏度之间进行平衡,图2为常用的一些蛋白质鉴定的方法:
组织匀浆法:将连续组织切片研磨并进行细胞裂解,使用有机溶剂对内源性蛋白质进行溶解并提取,采用蛋白质组学方法进行蛋白质鉴定;
原位酶解法:原位酶解法通过胰蛋白酶等内切蛋白酶将组织切片上的较大蛋白分子酶解为小肽段,因此可以直接在组织切片上进行MS/MS分析。
化学衍生法:通过对组织表面的靶标蛋白进行化学修饰,以增强其灵敏度和碎片效率等,如在MALDI TOF/TOF实验中常用的N末端衍生化方法,几乎只产生y离子,也是直接在组织切片上进行蛋白质鉴定,适用于靶向研究。
激光捕获显微切割(LCM, Laser Capture Microdissection):LCM常用于靶向组织样品及细胞样品的分析,通过显微镜和激光瞄准系统从异质环境中提取单个细胞样品。基于布鲁克SpatialOMx®空间定位组学,根据生物组织MALDI成像结果,在组织内部锁定目标微区(ROI,Region of Interests),然后对该目标微区实施激光微切割后,进行LC-MS/MS组学分析,从而实现了深度的蛋白组信息挖掘。
凝胶提取法:一般适合于空间靶向的蛋白质鉴定,先将凝胶放置在组织表面上,对空间定向的蛋白质进行消化从而将多肽提取到凝胶中,最后将多肽从凝胶上洗脱下来进行LC-MS/MS分析。
液体微萃取表面分析法(Liquid Extraction Surface Analysis ,LESA):在组织表面加入微量(0.5-3µL)萃取溶剂,将组织中的待测物萃取到溶剂中,再将溶剂从组织中析出,并进行检测分析,LESA技术可实现包括小分子代谢物到完整蛋白的各种物质的分析。
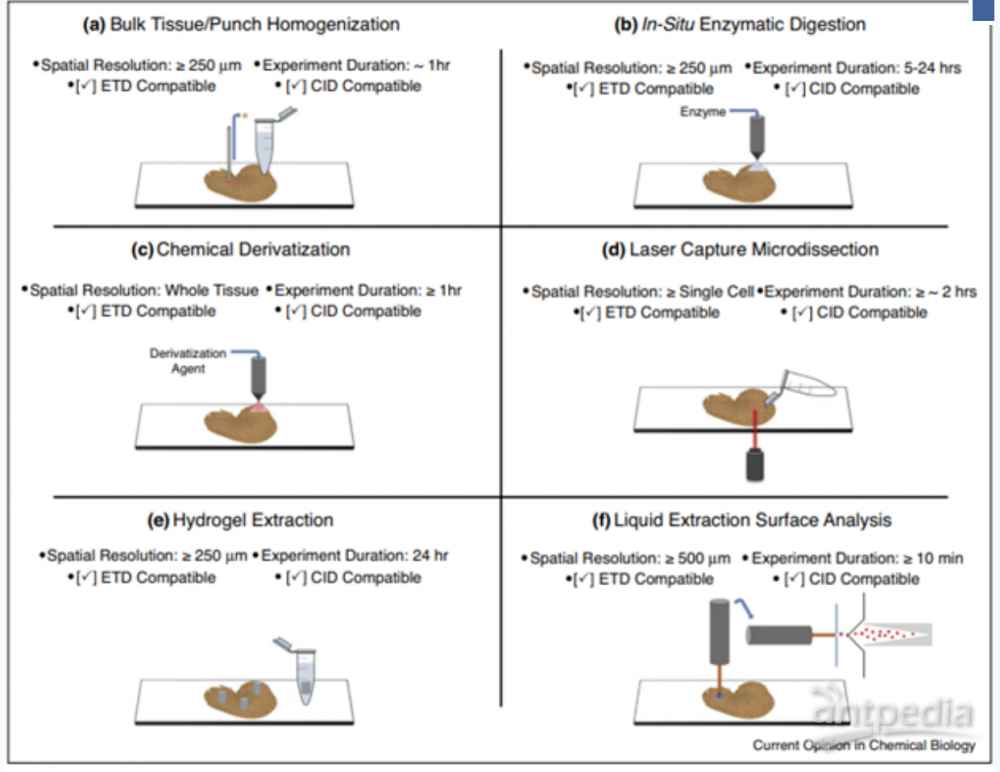
图2:MALDI TOF质谱成像中的几种蛋白质鉴定策略
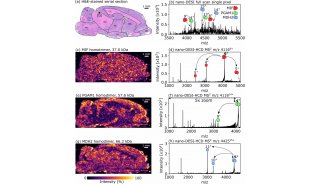
蛋白质的质谱成像在疾病发生机制研究、标志物发现、药物研发和疾病诊断等方面均有着广泛的应用。Kulbe等人基于布鲁克rapifleX MALDI-TOF成像平台对早期高级别浆液性卵巢癌进行了研究[3],实验通过自下而上的策略获得了4组复发病人和4组非复发病人的病理切片的蛋白成像数据,通过布鲁克SCiLS™ Lab软件中的多元统计学功能找到了151个在肿瘤区和非肿瘤区具有显著表达差异的多肽分子,同时根据原位酶解法成功鉴定到了13种蛋白质,其中角蛋白I和胶原蛋白α-2(I)可作为高级别浆液性卵巢癌复发的诊断标志物。MALDI质谱成像以空间分辨的方式监测组织中内源性分子(如脂质、蛋白和代谢物)的变化,可用作疾病诊断、预后和监测的个性化工具。近年来,MALDI质谱成像已逐渐应用到临床医学研究中,大大推进疾病生物标志物的发现,特别是在肿瘤学中,可帮助理解导致某些病理学的分子机制。
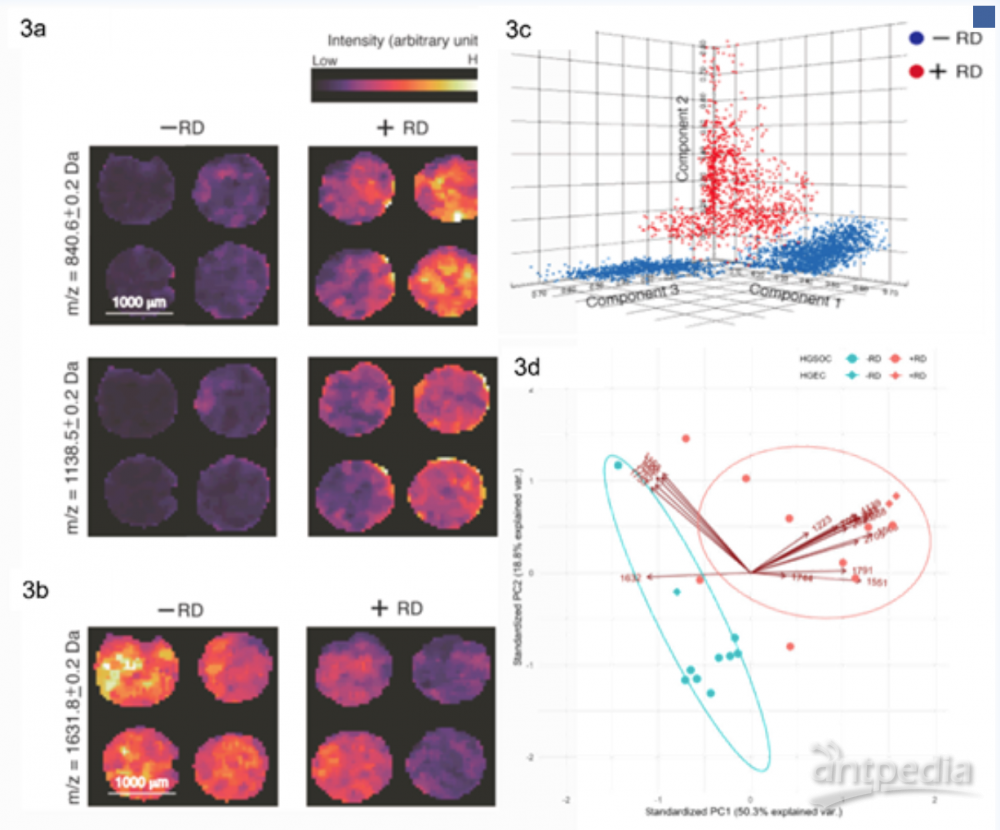
图3:3a: 在+RD组具有高表达的多肽分子的离子热图;3b:在-RD组具有高表达的多肽分子离子热图;3c:基于SCiLS Lab的蛋白成像数据的PCA分析得分图;3d:基于SCiLS Lab的蛋白成像数据的PCA分析载荷图。
布鲁克提供了完整的靶向和非靶向蛋白质成像分析方案:MALDI TOF/TOF系统拓宽的动态范围使质谱成像能够适用于涵盖从小分子物质(如脂类)到25kDa的完整蛋白分析应用,高效和高灵敏的LIFT、LID二级功能使得蛋白质的鉴定更加方便;timsTOF fleX系统基于MALDI引导的空间定位组学(SpatialOMx®)完美地将MALDI成像技术和LC-MS/MS组学流程结合在一起,可实现深度的蛋白信息的挖掘。同时,布鲁克的SCiLS™ Lab软件为质谱成像提供了一个全面的可视化图像和分析工具,包含了完整的生物标志物寻找的分析流程,将成像数据的价值发挥到最大。

图4:布鲁克蛋白成像平台
参考文献:
[1] Identification of proteins directly from tissue: in situ tryptic digestions coupled with imaging mass spectrometry, J.Mass Spectrom. 2007; 42: 254–262.
[2] Protein identification strategies in MALDI imaging mass spectrometry: a brief review, Current Opinion in Chemical Biology 2019, 48:64–72.
[3] Discovery of Prognostic Markers for Early-Stage High-Grade Serous Ovarian Cancer by Maldi-Imaging, Cancers 2020,12, 2000.
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章