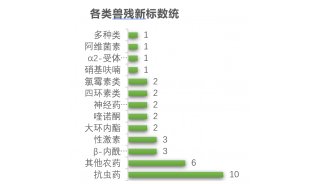
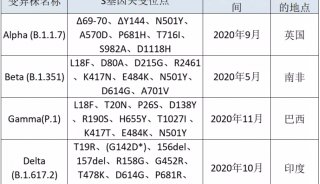
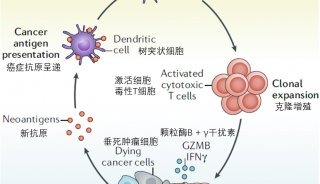
COVID-19质谱检测2」基于Cov-MS联盟协作验证检测可靠性
高效的人群检测,对主动监控诸如SARS-CoV-2 这样的病原体的传播是非常重要的,在降低传播方面提供了定量数据来支持决策者。在疫情开始的时候,COVID-19 几乎毫无例外地使用逆转录聚合酶链式扩增反应(RT-PCR)方法来检测,但是单纯依赖一种技术是有明显劣势的。这种在世界范围对RT-PCR 方法前所未有的需求,导致检测和其他必要试剂的长期短缺,限制了检测容量。
与基于PCR 的检测相比,质谱检测显著更加具有特异性,要求一个更宽的视角去处理不同的样本基质和仪器技术。因此,根特大学(Ghent University)的研究人员发起了一项基于Cov-MS联盟协作方案,该联盟已经产生了一个通用的、广泛适用的基于质谱的分析方案,可以轻松地适应广泛可变的测试设施环境。

研究者随后成立了一个协作联盟(MS-Cov),由15 个学术科研和工业实验室组成,SCIEX等业界主要质谱供应商也在列。研究者利用SCIEX TripleTOF™ 6600+ 系统上采用SWATH® 采集方法获得的高分辨率质谱仪器数据,创建了一个独立于质谱仪器供应商的Skyline文档,其中17个肽段生物标志物来自公开数据中检测到的两个SARS-CoV-2结构蛋白,即重组核衣壳蛋白(NCAP_SARS2)和刺突蛋白(SPIKE_SARS2)。向该联盟的所有成员提供了Skyline文件,以及包含重组NCAP和SPIKE蛋白的样品试剂盒,以及阴性患者背景下的稀释系列。15个实验室共享来自4个不同仪器供应商的数据,这些数据被集中收集,并用于供应商独立的免费软件(Skyline),以评估候选特征肽的最终整体方案性能和适用性,我们建立了Cov-MS数字孵化器,开放的交流和数据共享将有助于将该分析方案转化为全球不同的临床环境。所有补充数据均可在Cov-MS数字孵化器中获得。
Cov-MS联盟,提高MRM
检测的灵敏度和稳定性

图3. Cov-MS联盟报告(红色,图片引用自pubs.acs.org/jacsau) 。(A) 优化样品制备。比较不同的样本保存培养基、三氯乙酸(TCA)沉淀和15分钟的消化酶解(n = 5)。LogSumAUC的增加表示为对数转换。主要集中在三个优化方面:应用不同的酸沉淀策略,即用三氯乙酸(TCA)和盐酸(HCl),将消化酶解时间缩短到15分钟,以及使用不同的保存培养基。虽然这些改变可以提高整体的信号(图3),但最好的策略还是通过相关多肽的MRM方法优化和消除离子抑制或通过降低基质干扰以及实验条件更好。现在可以实现一个少于30分钟的完整样品制备工作流程。
(B)不同样品制备耗材的比较。在标准的工作流程中,肽段在水中溶解并转移到弹簧内衬管(SI)样品瓶。使用全回收(QR)小瓶,并在溶剂中加入5%的乙腈(ACN),可以提高溶剂中大部分肽段的信号,但在UTM中没有信号提升。底部的栏显示估计的整体增益归因于消耗品。

图3. Cov-MS联盟报告(红色,图片引用自pubs.acs.org/jacsau) 。 (C)增加eSwab样品的样本载样量。由于eSwabs使用生理盐水作为保存液,增加柱上样品的量可能是有益的。因此,我们评估了将载样量增加5倍的影响,无论是否使用SPE。整体平均LogSumAUC增加2.3倍(虚线),比如,信号增加了5倍,如果将样本分成5份,采用SPE策略 。也就是说,如果将5次50 μL的消化液浓缩到一个SPE柱上,至少可以相当于两个Ct值。自动化处理将使这一发现得到巩固和扩展,但是我们在这里提醒可能会有SPE过载现象。由于缺乏内部自动化处理方案,我们继续采用原来的操作过程,50 μL样品量和10 μL柱上进样时,不应采用SPE前处理。

图3. Cov-MS联盟报告(红色,图片引用自pubs.acs.org/jacsau) 。(D) Cov-MS联盟内的数据采集。为了简化所有这些并行实验方案,研究者为联盟成员提供了详细的方法优化标准操作程序(SOP)、包含17个肽段(145 个MRM)的Skyline模板和Cov-MS试剂盒。这些试剂盒含有重组核衣壳蛋白NCAP和刺突蛋白SPIKE的消化液,以及来自健康供体的UTM背景的稀释液体,一式三份。重要的是,研究表明只有新一代串联四极杆质谱仪器,能够达到足够的灵敏度。此外,汇编数据结果证实了最初的假设,所选肽段是具有实验特异性的。这些初步结果表明,不同的供应商可以从不同的目标肽段中通过叠加提高灵敏度,即使是相同的MRM。一个突出的例子是RGEPQTQGNFGDQELIR肽,它在SCIEX仪器上特别有效,可能是因为相应的离子源更适合于多电荷的多肽。
COVID-19质谱检测,用于评估
潜在检测性能的大型患者队列
研究者详细描述了Cov-MS联盟为建立一个稳定、灵敏的正交试验来诊确认SARS-CoV-2阳性所做的努力。为了能够跟踪每天进行的数百万次RT-PCR检测并与之保持一致,科学界的集体努力至关重要,这不仅仅是因为MRM检测以前很少被用于检测病毒。
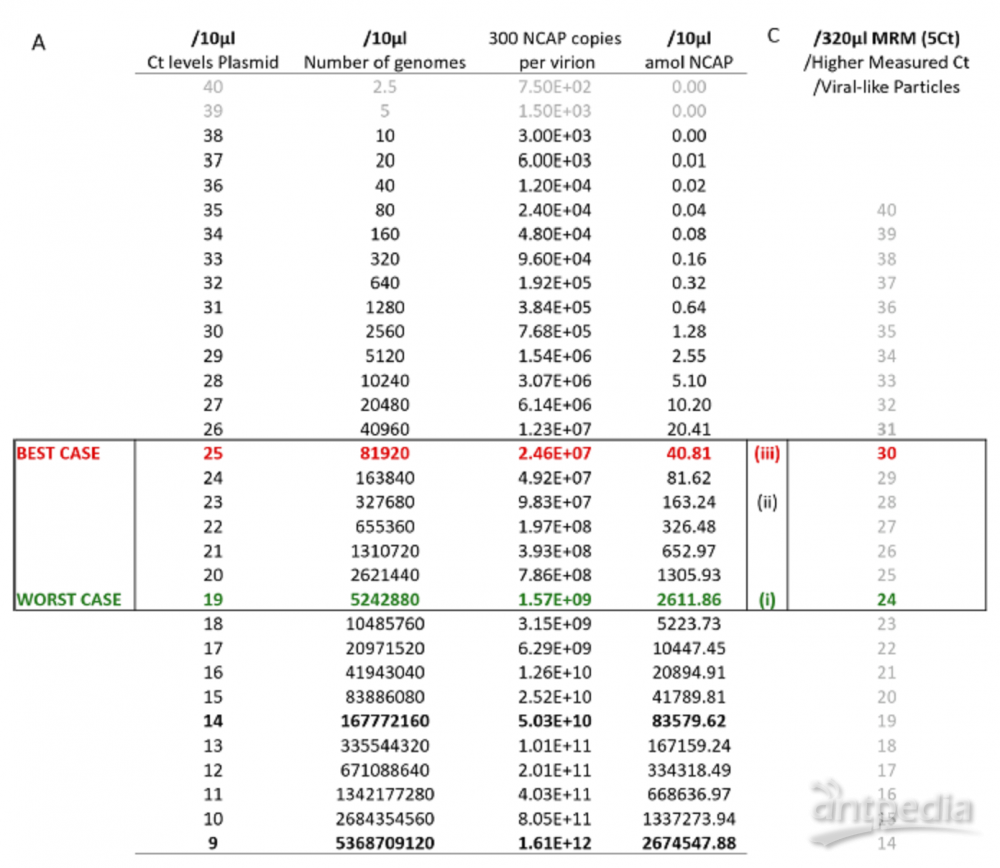
图5. MRM能力的预测。(A)理论上将Ct与MRM测定方法相关联的绝对量。在完美的条件下(即质粒),用内部RT-PCR检测10 μL样品中的10个基因组,Ct值为38;在Ct值为40时,检测2.5个基因组。假设每个病毒粒子携带300-350个核衣壳蛋白(NCAP)分子,可以很容易地计算出10 μL中NCAP分子的绝对数量。表中突出显示的部分 (C) Ct和MRM检测之间潜在的实际相关性。通过增加32倍的上样量,富集目标可以产生5倍 Ct值的灵敏度。临床RT-PCR预期比质粒更高,MRM信号可能因为病毒样颗粒(VLPs)而更高,这一事实映证这一点。
在大规模人群检测应用场景,
提高检测通量
基于液质工作流程的一个主要缺点是,数据采集不能在单个仪器上并行进行,而RT-PCR检测使用多孔板。然而,使用8分钟的梯度,一种仪器可以每天测量超过150名患者,通过多通道液相方案,这可以增加到每天500名患者。Cov-MS联盟的一名成员(Alderley analytics)还研究了2分钟梯度的应用,并表明当基质相对干净时,才可行,在没有并行方案的情况下,每台仪器每天可增加样本检测通量至600名患者。如我们的初步结果所示,在稳定同位素标记和抗肽段抗体俘获 (SISCAPA)等预先免疫富集的情况下,可以达到低至1分钟的梯度。至少从样品制备的角度来看,没有理由不能使用机器人自动化操作,就像RT-PCR制备一样。
最近有一项突破性的技术,可以进一步提高产量,那就是声波激发质谱(AEMS)。SCIEX Echo™ MS系统,纳升液滴以每秒三个样本的速率从样品中喷射到仪器中,每个液滴可测量4个MRM离子对。这可能会预期每台仪器每天采样约30000名患者。
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章