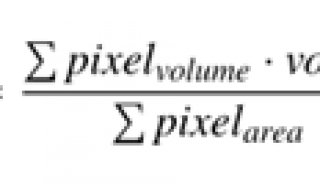Optics Letters:OCT啮齿动物脑无创活体成像
生物组织中,近红外波长较长通常散射较少,水吸收较多。加利福尼亚大学研究人员Jun
Zhu等展示了一个以2.1 μm为中心的光学相干断层扫描(OCT)系统,其带宽落在2.2
μm的水吸收光学窗口内,用于啮齿动物大脑的体内成像。成像结果显示,使用2.1 μm光在颅骨中的OCT信号衰减实际上比1.3
μm更少,并且对多次散射拖尾也不太敏感。此外2.2 μm窗口能够直接光谱OCT评估组织含水量。因此通过进一步优化,2.2 μm
OCT将在低含水量组织(如骨)以及可能进行广泛平均以补偿吸收损失的应用中具有优势。文章以“Noninvasive, invivo rodent
brain optical coherence tomography at 2.1 microns”为题发表于Optics Letters。
背景
以高分辨率更深入地观察生物组织是生物光子学的基本目标。然而,组织对光的散射和吸收限制了成像深度的发展。波长较长,散射系数(μs)降低,而吸收系数(μa)通常会增加。已知水局部地吸收落在位于1.05、1.3、1.7和2.2
μm附近的近红外光学窗口内。在光学相干断层扫描(OCT)中,更倾向于使用长波长,即使水吸收更高,但散射更少,意味着检测到的OCT信号比例更高,通常OCT使用的是1.3
μm窗口。1.7 μm虽然使用频率较低,但它散射更低,并且在脑等组织的深度显微镜检查中,衰减系数最低。由于光源限制和高吸水性,2.2
μm左右的光学窗口更少用于组织成像。与其他组织相比,骨是一种具有中等质量含水量(12%)的生物组织,尚未探究过2.2
μm在体内成像骨组织中是否具有优势。
本研究描述使用2.1 μm
OCT进行啮齿动物脑活体无创成像。发现在颅骨内2.1 μm光的衰减实际上低于传统的NIR窗口1.3 μm的衰减。进一步使用2.1
μm透过完整颅骨对大鼠进行皮质OCT血管造影。除预期的多次散射光减少之外,更重要的是发现2.2
μm光谱窗口在体内OCT中的额外优势:骨衰减更低,并可以直接光谱评估含水量。
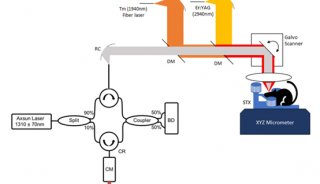
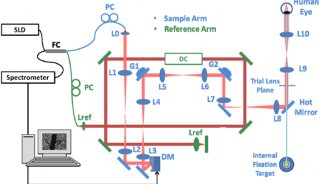
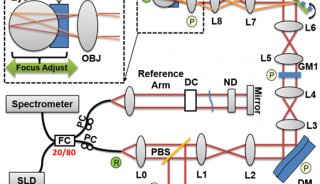
2.1
μm OCT系统配置如图1A所示。超连续谱光源(SuperK EXR20,NKT
Photonics)经两个带通滤波器(BBP-1615–2280,Spectrogon;FB2250–500,Thorlabs,Inc.)过滤后,通过反射准直器(RC02,Thorlabs,Inc
.)耦合到定制的50/50
SM2000光纤耦合器(Thorlabs,Inc.)中。在样品臂中,光束由反射准直器(RC04,Thorlabs,Inc.)准直,经2D检流计(GVS002,Thorlabs,Inc.)扫描,通过扫描透镜(LSM02或LSM03,Thorlabs,Inc.)聚焦到样品上。在参考臂中,由一个改变参考功率的可调光阑和一个玻璃板补偿样品臂色散。来自样品的反向散射光和来自参考镜反射的光由光纤耦合器重新组合,并转给定制的光谱仪。在光谱仪中,光束经90°离轴抛物面镜(MPD249-P01,Thorlabs,Inc.)准直,由衍射光栅(刻线数600条/mm,Wasatch
Photonics)散射,由150 mm有效焦距长度消色差双合对(Thorlabs,Inc
.)聚焦,并由扩展InGaAs线阵相机(SU1024LDH-2.2RT,Sensors
Unlimited)检测。相机由外部触发并与2D检流计扫描同步。数据通过帧抓取器(PCIe-1427,NationalInstruments
Corp.)来收集。所有的硬件控制都是由一个定制的LabVIEW程序执行的。光谱仪的光谱范围为1990–2210
nm(图1B)。在成像范围的前半部分,灵敏度衰减小于5 dB(图1C)。空气中测得的轴向分辨率为18.6 μm(水中为14.0
μm)(图1D)。获得的样品的1/e2横向分辨率为16/32 μm(LSM02/LSM03)。4.3 mW入射功率和14.1 μs(47 kHz扫描速度)相机曝光时间下,最大灵敏度约84 dB。
系统噪声源可通过改变摄像机捕获的参考功率/光电子数来表征。对于线阵相机中的每个像素,总噪声与检测到的光电子数之间的关系用二次函数拟合,二阶非线性项、一阶线性项和常数项分别指定为过量噪声、散粒噪声和检测器噪声。当相机以小(1.25Me-)/大(12.5Me-)满阱容量(FWC)和短(14.1
μs,47 kHz)/长(79.9 μs,12
kHz)曝光时间模式运行时,分析了相对于散粒噪声极限(SNL)的系统灵敏度(图1E)。相对于SNL的最大系统灵敏度约为3.2%,受高探测器噪声和光源过量噪声的限制(图1F)。
图1 (A)2.1 μm OCT系统示意图。(B)水中不同深度的光谱,参考光谱0 μm,(C,D)灵敏度衰减和轴向分辨率与色散补偿深度的关系。(E)不同相机操作模式下,系统灵敏度与散粒噪声极限的关系。(F)使用小FWC、长EXP模式的不同噪声源的贡献。
结果
选择Long-Evans(1-2号)和Sprague-Dawley(3-5号)大鼠(雄性,200-300g,Charles
River),用异氟烷(1.5-2.5%
v/v)在80%医用空气和20%氧气的气体混合物中麻醉,并在实验过程中连续输送。麻醉后,将大鼠固定在立体定向框架内(Stoelting
Co.)。小心取下头皮,保持头骨完好无损。用强力胶(Vibra-Tite)将盖玻片固定在颅骨上,成像视野为2 × 2 mm2/2.5× 2.5 mm2。使用扫描透镜LSM02/LSM03时,入射样品功率为3.5/4.3
mW。对采集的条纹进行重采样、分配补偿和傅里叶变换,得到复杂的OCT数据。为提供两个光学窗口的内在比较,不考虑OCT系统的性能,对强度(复数据的模平方)图像进行了深度相关噪声背景和灵敏度下降的校正。基于分割的颅骨表面,每个亚位置内的体积数据被展平,然后横向平均以产生线轮廓。对于定量衰减系数分析,假设nskull = 1.5和ncortex = 1.33的折射率。
在同一只大鼠中,通过顺序获得的1.3 μm和2.1 μm OCT颅骨和皮层的截面图像(图2A,B;n = 1.33),说明了颅骨与大脑的衰减特征不同(图2C)。然后将视场分为九个子区域进行总衰减系数测量,共焦门控的计算如下:
其中z是深度,I(z,λ)表示OCT线轮廓,z0(λ)是高斯光束瑞利范围,zcf(λ)表示光束腰的深度位置,设置为近似聚焦位置。OCT信号衰减用指数衰减项来描述,其中因子2表示双程衰减,C是常数。比较了三只大鼠跨27个子区域的浅层皮层I(图2C绿色阴影区域)中的衰减系数(图2D)。two-way
ANOVA确定统计显著性。在颅骨中,由于散射较低,2.1 μm OCT信号比1.3 μm衰减得慢(P <
0.001),而在含水量高的皮层I中,2.1 μm的衰减系数更大(P < 0.001)。
还注意到,在1990-2210
nm光谱范围内,吸水率显著降低。如果散射得到适当的处理,这一特征可以实现水体积分数的光谱评估(与水含量成比例)。因此,将光谱分成7个子带,中心波长分别为2009、2037、2065、2094、2123、2154和2186nm,半峰全宽约为36nm。在成像视场的每个子区域中,背景和灵敏度滚降被校正,然后用共焦门控和单次散射的组合模型拟合局部平坦且横向平均的OCT信号,

这里,子带之间的色焦移包含在zcf (λ)中。衰减系数μt (λ)是散射衰减[μt,s(λ)= A(λ/500)-b]的和,与μs不同,它包括多重散射效应和水吸收[fwμa,w (λ)],其中b是散射功率,fw是水的体积分数。由于b依赖于样本且先验未知,因此它被顺序固定在从0到1.5的假设值,而C、fw和A使用非线性最小二乘回归对每个假设b进行拟合。
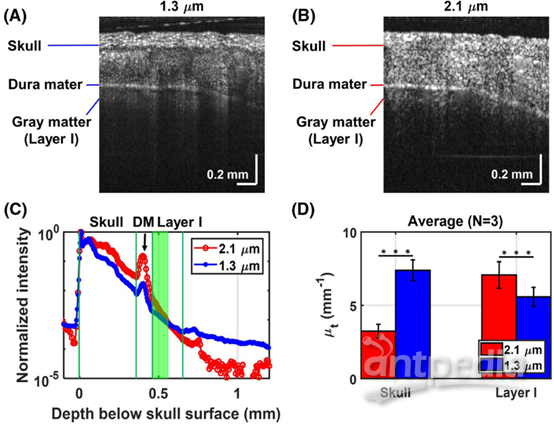
图2 使用(A)1.3μm和(B)2.1μm系统的大鼠头盖骨和皮质的截面图像。(C)组织OCT信号线轮廓,绿线界定颅骨和皮质层Ⅰ的边界(糖尿病,硬脑膜)。绿色阴影区域代表皮质层Ⅰ的拟合范围。(D)1-3号大鼠的平均组织衰减系数(平均标准偏差)。水平线表示由two-way
ANOVA确定的统计学显著差异。
基于上面公式中的模型估计水体积分数(fw)(图3)。为了首先评估该方法,进行了离体模型实验。图3A显示了在25%(v/v)脂肪乳剂-20(IL-20)溶液(去离子水稀释)的每个子带中归一化OCT信号的拟合。假设散射功率为0.5,拟合的总衰减系数(图3B中的红色)遵循整个光谱的吸水性(蓝色虚线),表明含水量高。衰减主要由吸收[fwμa,w(λ)](蓝色),而不是散射[μt,s(λ)= A(λ/500)-b](绿色)。由于假设的b值从0到1.5不等,IL-20溶液的估计fw从94.1到91.5%不等(图3C),接近94.3%[0.25
×( 1–22.7%)+0.75]的估计值,假设纯IL-20中散射粒子的体积分数为22.7%。图3D显示了归一化的OCT信号在干式光学漫射器(WS-1,Ocean
Optics)每个子带中的拟合。假设散射功率为0.5,拟合的衰减系数(图3E)在整个光谱范围内变化很小,表明含水量较低。由于假设的b值从0变化到1.5,估计的fw在9.8-6.5%变化(图3F)。拟合程序返回非物理负fw值,以补偿较大假设b的较大衰减变化。
给定这些在人体模型中的合理结果,然后我们在体内分割和分析大鼠颅骨和大脑皮层Ⅰ,应用公式2中的模型,并假设在该波长范围内,水是颅骨和皮层中的主要吸收剂。在体内分析中,最长波长子带被丢弃,因为皮质灵敏度差,受探测器量子效率的限制。大鼠颅骨(图3G)和表层皮质层I(图3J)中的标准化体内OCT信号的拟合表明,假设合理的散射功率为0.5,颅骨(图3H)中频谱的拟合总衰减系数比层I(图3K)中的变化小,表明颅骨中的含水量较低。因此,体内拟合(图3I和3L)估计,皮质层I与颅骨相比具有更高的水体积分数(60-70%)(~
20%)。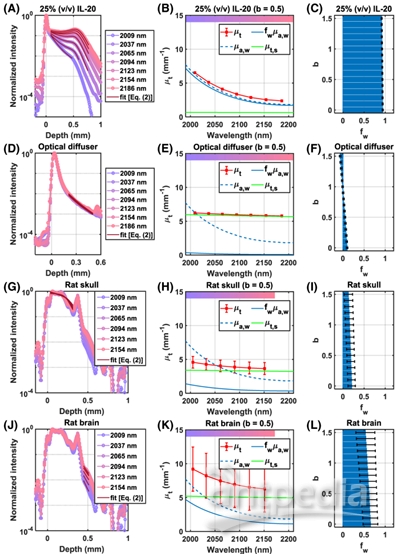
图3 基于吸收的水体积分数的光谱测量。(A,D,G,J)25%(v/v)IL-20溶液、干式光学扩散器、颅骨和大脑(大鼠#2)的归一化OCT子带线轮廓。线条轮廓拟合(黑色实线)基于等式(2)。(B,E,H,K)波长相关的拟合衰减系数(μt)(红色)确定为拟合吸收衰减(fwμa,w)(蓝色)和拟合散射衰减(μt,s)(绿色)之和,假设散射功率b为0.5。纯水吸收(μa,w)以供参考(蓝色虚线)。(C、F、I、L)估计的水体积分数(fw)弱依赖于假设的b。
通过1.3
μm和2.1 μm系统获得的大鼠头盖骨和皮质的正面血管造影照片(图4A,B;n =
1.33用于图像显示)是相似的。由于横向分辨率(分别为15μm和16μm)非常接近,尽管2.1μm
OCT系统的性能不是最佳的,但成像质量显著具有可比性。为评估多次散射,在对血管造影照片进行局部平坦化和平均化之后,在图4C中比较了来自1.3和2.1
μm处的橙色感兴趣区域的归一化颅骨血管线轮廓。在线轮廓中,血管管腔从60到30
μm,而多重散射拖尾开始于30μm左右。总体而言,在六个相似的ROI中,2.1
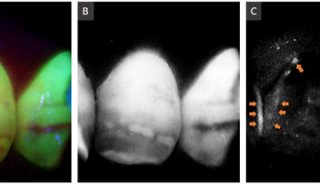
μm的拖尾幅度比1.3μm的低41±9%。此外,2.02–2.12μm子带中血管造影的颅骨血管线轮廓相似(图4D),表明水吸收不是主要影响因素。相反,2.1μm附近的较低散射可能解释了较低的拖尾幅度。在2.1μm(图4E–4G)对2号和4–5号大鼠进行的深度彩色编码正面血管造影显示,硬脑膜上方的颅骨血管为蓝色,皮质血管为红色(与硬脑膜的距离用nskull= 1.5和ncortex= 1.33计算)。表层皮质脉管系统通过完整的颅骨被分解。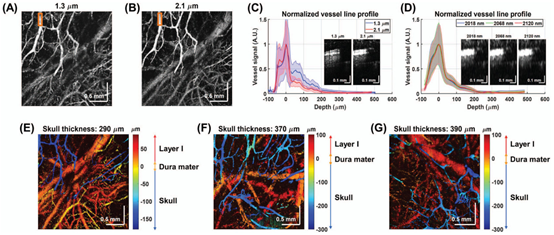
图4 由(A)1.3
μm和(B)2.1 μm
OCT系统获得的大鼠头盖骨和皮质的正面血管造影照片。(C)感兴趣区域(橙色方框)中的颅骨血管线轮廓在2.1μm时显示出尾部变小,这由ROI内两个波长的横截面血管造影照片所证实(插图)。(D)ROI内的子带颅骨血管线轮廓在2.02-2.12μm之间相似,如ROI内的截面血管造影照片所示(插图)。(E–G)深度(到硬脑膜的距离)编码的不同颅骨厚度的大鼠(大鼠#2和#
4–5)正面血管造影照片。请注意,在C和D中,假设折射率为n = 1.33,而在E–G中,nskull = 1.5,ncortex = 1.33。
目前,由于探测器和光源噪声,系统灵敏度非常有限。此外,并非所有使用的光学元件都针对2.1
μm进行了优化,这进一步降低了灵敏度。例如,样本臂中的扫描透镜(LSM02/LSM03)有64%/42%的双程损耗。定制光学系统将提高最大灵敏度。灵敏度也可以通过具有较低损耗和双平衡检测的扫频源系统来提高。一个散粒噪声受限的低损耗系统可以达到100
dB以上的灵敏度。对于颅骨含水量,胶原蛋白吸收的潜在作用值得进一步研究。此外,60-70%的皮质水体积分数略低于预期。将来,加权吸水系数以说明每个子带的有限光谱宽度可以提高定量精度。关于散射功率的更好的先验信息也将提高精度。
结论
本文证明了一种在2.2
μm光谱窗口工作的新型OCT系统被证明可用于啮齿动物大脑的无创体内成像。尽管由于水吸收较高,2.2
μm通常不用于生物成像,但本文的体内研究显示,对于骨这种低含水量的生物组织,2.1 μm实际上具有比1.3
μm更低的OCT衰减。尽管系统性能有限,但2.2
μm窗口的内在优势得到了确认,包括颅骨衰减更低、对多次散射的免疫力更强以及用光谱定量组织含水量的能力,在相关研究中可能发挥出意想不到的效果。
参考文献:Zhu, Jun , et al. "Noninvasive, in vivo rodent brain optical coherence tomography at 21 microns." Optics Letters 44.17(2019):4147.