恒光讲堂|金属-多酚纳米系统用于近红外二区NIR-II荧光引导的光热疗法和放射疗法的协同治疗
本文要点:光热疗法(PTT)被认为是一种有效的肿瘤消融治疗方法。光热剂(PTA)将光子转化为热量,这种热疗可以快速消融实体肿瘤。近红外(NIR)激光产生的光子能量较高,组织吸收/散射较低,导致组织穿透深度比在紫外可见区域的光更深,因此被认为适合PTT。NIR激光诱导的PTT是可控的,对几种肿瘤类型的副作用可以忽略不计,包括前列腺癌、肝癌、脑癌等。在PTT过程中,病变区域被加热到42℃或更高温度,以诱导不可逆的细胞坏死。然而,PTA在病变中的不均匀分布有时会导致温度不均匀,导致PTT期间区域温度低于42℃,由此,肿瘤可能复发,导致治疗过程失败。提高治疗温度可能是避免肿瘤复发的相关解决方案,尽管遗憾的是,这种方法可能刺激过度激活的炎症反应。因此需要PTT与适当低温操作的协同治疗策略。
在本文中,作者设计并合成了一种带有多酚部分的半导体聚合物CPPDA螯合高原子序数金属 Hf离子,随后用两亲性聚合物(Pluronic F127)包覆以形成110 nm的纳米结构。CPPDA-Hf@Poloxamer在NIR-II区域内显示荧光,用于病变部位精准成像的同时用于PTT具有合适的光热转换效应。对于Hf-多酚的螯合作用,高原子序数 Hf离子赋予该纳米系统放射增敏性能,从而中和PTT过程中肿瘤复发的缺陷。最终,当PTT与HF增敏放射治疗相结合时,合理地获得了显著的治疗效果。金属-多酚纳米系统利用第二近红外(NIR-II)荧光引导协同PTT/RT示意图如下(方案1)。

CPPDA与Hf离子螯合(图1A),并用两亲性聚合物Pluronic F127包覆,形成纳米颗粒(CPPDA-Hf@Poloxamer),利用透射电子显微镜(TEM)观察核-壳颗粒结构,粒径约为100 nm(图1B)。对于金属-多酚螯合,Hf离子在单个CPPDA-Hf@Poloxamer纳米颗粒中的分布利用高角度环形暗场扫描透射电子显微镜(HAADF-STEM)证实了这一点(图1C)。利用能量色散X射线光谱(EDX)分析确认Hf与CPPDA的准确螯合作用(图1D)。CPPDA-Hf@Poloxamer中的Hf比率计算结果为通过电感耦合等离子体质谱(ICP-MS)测定2.7 wt%。CPPDA-Hf@Poloxamer在808 nm激光(900–1500 nm)下具有宽吸收(600–1100 nm)和宽NIR-II发射(图1E)。CPPDA-Hf@Poloxamer也可能被1064 nm激光激发,并显示出类似的NIR-II发射,表明CPPDA-Hf@Poloxamer可作为一种潜在的近红外荧光显像剂。CPPDA-Hf@Poloxamer的NIR-II荧光使用成像仪器(图1F,λex=808 nm)进行了研究,并显示了强度和浓度之间的线性关系(图1G),这进一步证实了CPPDA-Hf@Poloxamer的良好成像特性. 量子产率(QY)计算为1.9%(λex=808nm,IR 1061作为标准参考,QY=1.8%)和0.57%(λex=1064nm,IR 26为标准参考,QY=0.05%)。在两种不同波长的激光照射下,纳米颗粒浓度与NIR-II荧光强度表现出良好的线性关系,证明了CPPDA-Hf@Poloxamer的光学稳定性,由于其在600至1100 nm范围内的广泛吸收,CPPDA——Hf@Poloxamer应具有良好的光热转换性能。CPPDA-Hf@Poloxamer的光热容量在不同浓度(0.5~0.03125 mg/mL),在808 nm辐射(P=1 W c m-2)下测量。通常,CPPDA–Hf@泊洛沙姆的最大温升为55℃,0.5 mg/mL(图1H)。由于在1064 nm处的吸收(P=1 W c m-2),还测量了CPPDA–Hf@Poloxamer在1064 nm辐照下的光热容量,最大温升为44.9℃, 0.5 mg/mL (图1I)。进行光热成像以可视化温度升高过程(图1J)。然后,CPPDA-Hf@Poloxamer的冷却曲线(0.5 mg/mL)在辐照(λex=1064 nm,P=1 W c m-2)下测得(图1K)。因此,CPPDA-Hf@Poloxamer的光热转换效率计算了两个辐射波长分别为808和1064 nm的辐射。CPPDA-Hf@Poloxamer的光热转换效率在1064nm照射下(45.5%)高于808nm照射下(33.3%)。因此,CPPDA-Hf@Poloxamer可作为一种具有近红外II区荧光和光热性质的良好显像剂。根据CPPDA-Hf@Poloxamer的这些光物理性质,作者认为能够使用808nm激光识别病变部位,并使用1064nm激光产生热量消融实体瘤。

为了研究CPPDA–Hf@Poloxamer在体外的抗癌作用,随后作者采用MTT法评估4T1乳腺癌细胞的生存能力。CPPDA-Hf@Poloxamer即使在相对较高的1 mg/mL 浓度下也没有细胞毒性(图2A)。在X射线(6 Gy)照射下,CPPDA-Hf@Poloxamer对细胞活力有明显的抑制作用。与不含Hf的纳米颗粒CPPDA@Poloxamer相比,CPPDA–Hf@Poloxamer在X射线照射下实现了细胞毒性的明显增强,表明Hf离子的放射增敏效应。使用4–8 Gy范围内的X射线辐照功率,CPPDA——Hf@Poloxamer细胞毒性逐渐增强(图2B)。

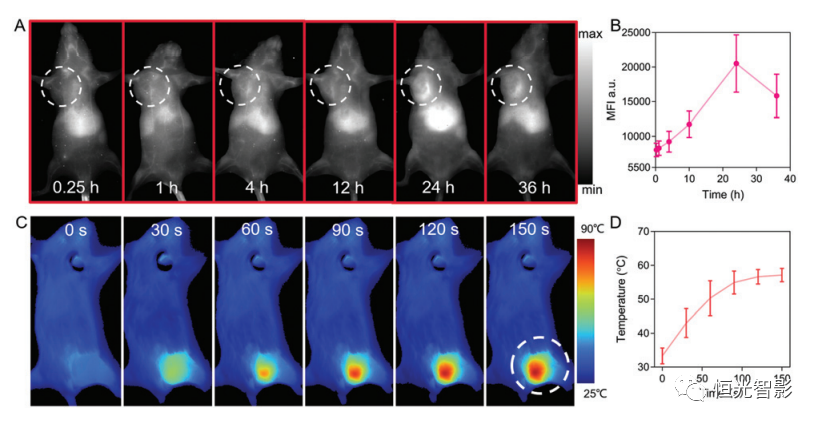
为了评估CPPDA-Hf@Poloxamer在体内的可追溯性和累积性,作者对携带4T1肿瘤的小鼠进行NIR-II区域内全身成像。在808nm照射下,肿瘤区域内的荧光强度逐渐增加(图3A)。CPPDA-Hf@Poloxamer累积在肿瘤中,荧光强度在24小时达到峰值,之后荧光强度降低到该值的77%左右,表明一个代谢过程(图3B)。注射CPPDA–Hf@ Poloxamer 24小时后,在1064 nm辐射(1 W cm-2)下,肿瘤区域的温度在120秒内迅速升高至56 ℃(图3C和D)。这种产生的热量足以用于PTT,表明CPPDA-Hf@Poloxamer具有潜在光热治疗性能。

图3 CPPDA-Hf@Poloxamer在体内的成像特性。肿瘤区域用白色圆圈标记。(A)静脉注射CPPDA-Hf@Poloxamer(1 mg/mL)治疗后4T1荷瘤小鼠的NIR-II荧光成像;λex =808纳米。(B)肿瘤区域的平均荧光强度(MFI)曲线。(C)注射CPPDA-Hf@Poloxamer 24小时后4T1荷瘤小鼠的光热成像(1 mg/mL);λex=1064纳米。(D)肿瘤区域内的温度变化曲线。
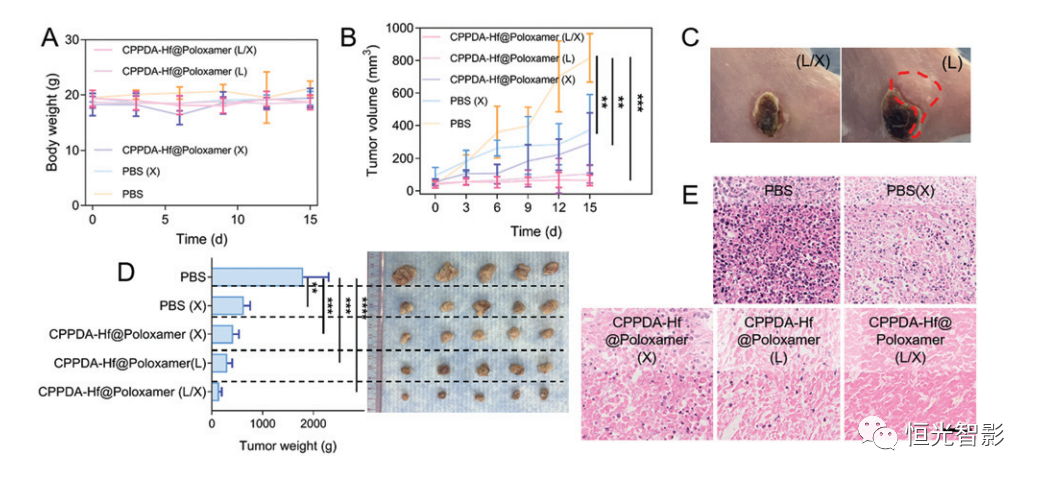
为了研究CPPDA–Hf@Poloxamer的抗癌作用,通过静脉注射CPPDA–Hf@Poloxamer对4T1荷瘤小鼠进行了不同的治疗. 经过各种处理后,发现没有明显的重量损失,这表明纳米材料具有合理的生物安全性(图4A)。注射CPPDA-Hf@Poloxamer后产生肿瘤抑制效应(图4B),在1064 nm激光(L)和X射线(X)的联合照射下显示出最有效的肿瘤抑制效应。在第6天终止治疗后,肿瘤体积开始逐渐增大,这表明CPPDA-Hf@Poloxamer对肿瘤生长的抑制有限。由于X射线在CPPDA-Hf@Poloxamer中的参与(L/X)激光组肿瘤生长停止。因此,放疗与PTT的联合应用可以有效地最大限度地提高抗肿瘤疗效。在病灶中能观察到肿瘤抑制的这种差异(图4C)。此外,我们还通过比较CPPDA-Hf@Poloxamer(X)组和PBS(X)组,进一步证实了Hf离子的放射增敏作用。治疗后,处死小鼠,剥离肿瘤称量并成像(图4D)。在苏木精-伊红(H&E)染色的肿瘤切片中,在CPPDA-Hf@Poloxamer(L/X)中观察到明显的膜溶解和细胞坏死,CPPDA-Hf@Poloxamer(L)和CPPDA-Hf@Poloxamer(X)组(图4E)最终证明联合PTT/RT具有令人钦佩的抗肿瘤作用,CPPDA-Hf@Poloxamer使用NIR-II激光和X射线照射呈现出良好的肿瘤消退特性。这些结果表明治疗过程中所有材料的系统安全性。
参考文献
Li Jie, etal."A metal-polyphenolic nanosystem with NIR-II fluorescence-guidedcombined photothermal therapy and radiotherapy.." Chemical communications(Cambridge, England) .(2021): doi:10.1039/D1CC04628D.
⭐️ ⭐️ ⭐️
近红外二区小动物活体荧光成像系统 - MARS
NIR-II in vivo imaging system
有不同型号的样机可以测试,请联系:
艾中凯(博士)
132 6299 1861
⭐️ ⭐️ ⭐️
恒光智影
上海恒光智影医疗科技有限公司,专注于近红外二区成像技术。致力于为生物医学、临床前和临床应用等相关领域的研究提供先进的、一体化的成像解决方案。自主研发近红外二区小动物活体荧光成像系统-MARS。
与基于可见光波长的传统成像技术相比,我们的技术侧重于X射线、紫外、红外、短波红外、太赫兹范围,可为肿瘤学、神经学、心血管、药代动力学等一系列学科的科研人员提供清晰的成像效果,助力科技研发。
同时,恒光智影还具备探针研发能力,我们已经成功研发了超过15种探针,这些探针将广泛地应用于众多生物科技前沿领域的相关研究中。
⭐️ ⭐️ ⭐️
上海恒光智影医疗科技有限公司
地址:上海市浦东新区张江高科碧波路456号 B403-3室
网址:www.atmsii.com
邮箱:ai@atmsii.com
电话:132 6299 1861 (同微信)
⭐️ ⭐️ ⭐️