PNAS | IF:12+ 非靶向代谢组学探究缓解复发多发性硬化症的应用


(点击图片报名千万医学支持计划)
前言
多发性硬化(MS)是一种主要影响年轻人的神经炎症和脱髓鞘中枢神经系统(CNS)疾病。它由一系列广泛的免疫成分组成,这些免疫成分使中枢神经系统中的轴突髓鞘退化。尽管在过去二十年中,MS免疫调节药物的研究和开发出现了巨大的热潮,但没有令人满意的治疗方法可以为患者提供长期康复治疗。大多数药物的最大挑战是严重的副作用和较差的耐受性。因此,迫切需要识别新的分子靶点并利用免疫途径转化为MS治疗。
2022年6月,亨利福特医疗集团在Proc Natl Acad Sci USA(IF:12.779)上发表的题为“Blood-based untargeted metabolomics in relapsing-remitting multiple sclerosis revealed the testable therapeutic target”的研究成果,本研究使用非靶向代谢组学,测量了35名复发缓解性多发性硬化症(RRMS)患者和14名健康对照组的血清代谢物,发现RRMS患者的甘油磷脂、柠檬酸盐循环、鞘磷脂和丙酮酸盐代谢这四条代谢途径发生显著改变。而为这四条途径提供能量的共同上游代谢途径是糖酵解途径,随后通过实时生物能量分析显示与糖酵解有高度相关,为RRMS治疗提供新的参考。

研究背景
代谢组学可以为生物体内发生的瞬时生理或病理变化进行检测,因此利用代谢组学表征和识别RRMS患者血清样本中受干扰的代谢途径,并使用药理学方法以其为靶点,使用经典的临床前MS小鼠模型研究其在疾病进展中的治疗潜力。
研究思路
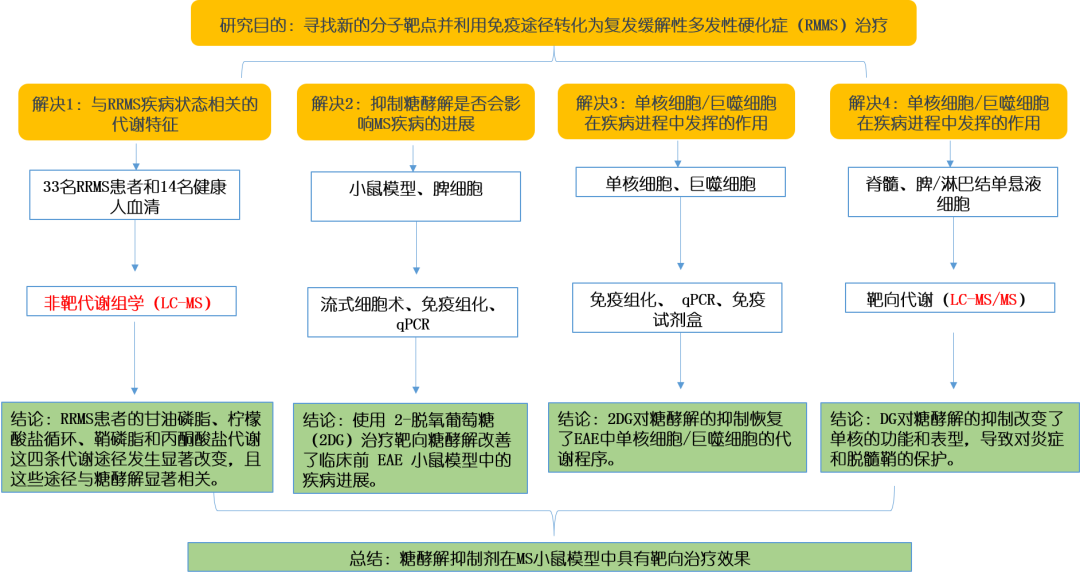
研究结果
1.与健康受试者相比,RRMS患者表现出明显的血清代谢特征
为了确定与RRMS疾病状态相关的代谢特征,作者对33名RRMS患者和14名年龄和性别匹配的健康受试者(HS)的血清进行了非靶向整体代谢分析。结果鉴定到632个代谢物(图1),其中60个代谢物在HS和RRMS组间发生显著改变(P<0.05,FDR<0.10),变化最大的代谢物属于脂质(46%)和外源物质(20%)代谢途径,其次是肽(12%)、氨基酸(7%)、维生素(5%)、碳水化合物(5%)、能量(3%)和核苷酸代谢途径(2%)。作者采用因果网络分析(CNA)发现G蛋白偶联鞘氨醇-1-磷酸受体2(S1PR2或S1P2)预测是在疾病期间被激活的主要调节因子之一。
为了进一步了解与改变的代谢物相关的信号节点和通路,作者还进行了通路分析(IPA),结果显示鞘氨醇和鞘氨醇-1-磷酸代谢最显著的途径。三项分析均显示与鞘氨醇-1-磷酸代谢的共同代谢途径相关,已知其在调节MS炎症中起关键作用。因此,作者对RRMS患者的代谢分析证实并验证了代谢产物的改变反映了疾病的生物学过程。
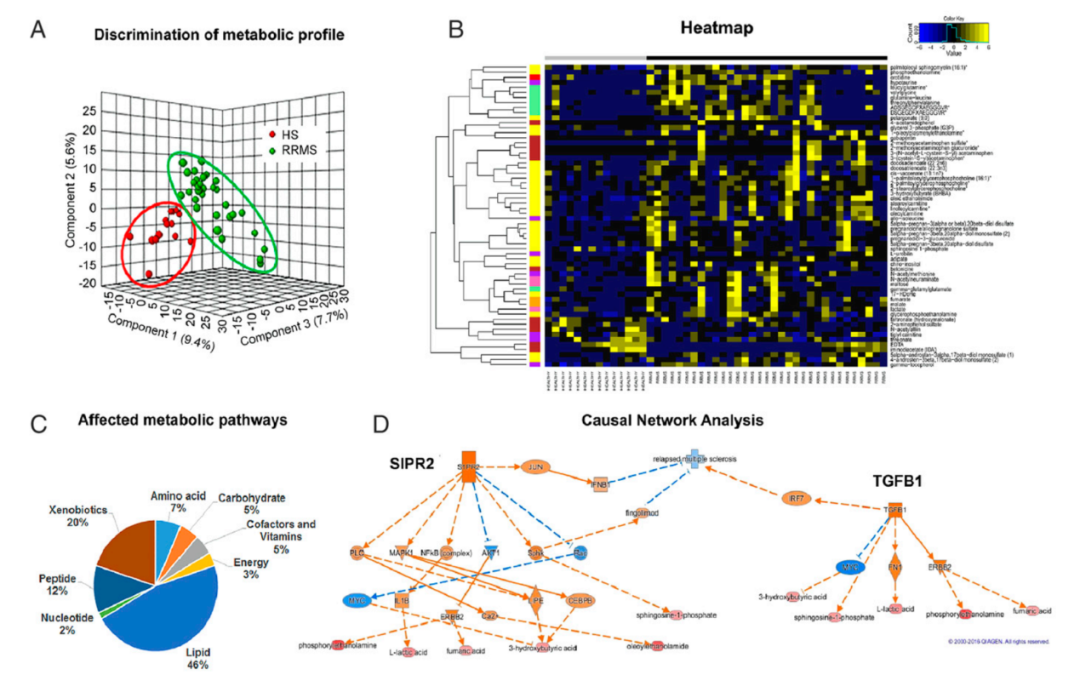
图1 | 与HS相比,RRMS患者的代谢轮廓发生改变
Metscape分析结果显示,与HS相比,RRMS患者的富集到的通路网络更加丰富(图2)。包括糖酵解、三羧酸循环(TCA)、尿素、嘌呤、酪氨酸、丁酸、磷脂酰肌醇磷酸酯、甘油鞘脂、嘧啶、氨基糖、蛋氨酸和半胱氨酸等代谢途径,在MS疾病期间受到很大影响,并反映在血液中(图2)。Kegg通路分析,发现显著富集到甘油磷脂代谢、柠檬酸循环(TCA)、鞘脂代谢和丙酮酸代谢途径。
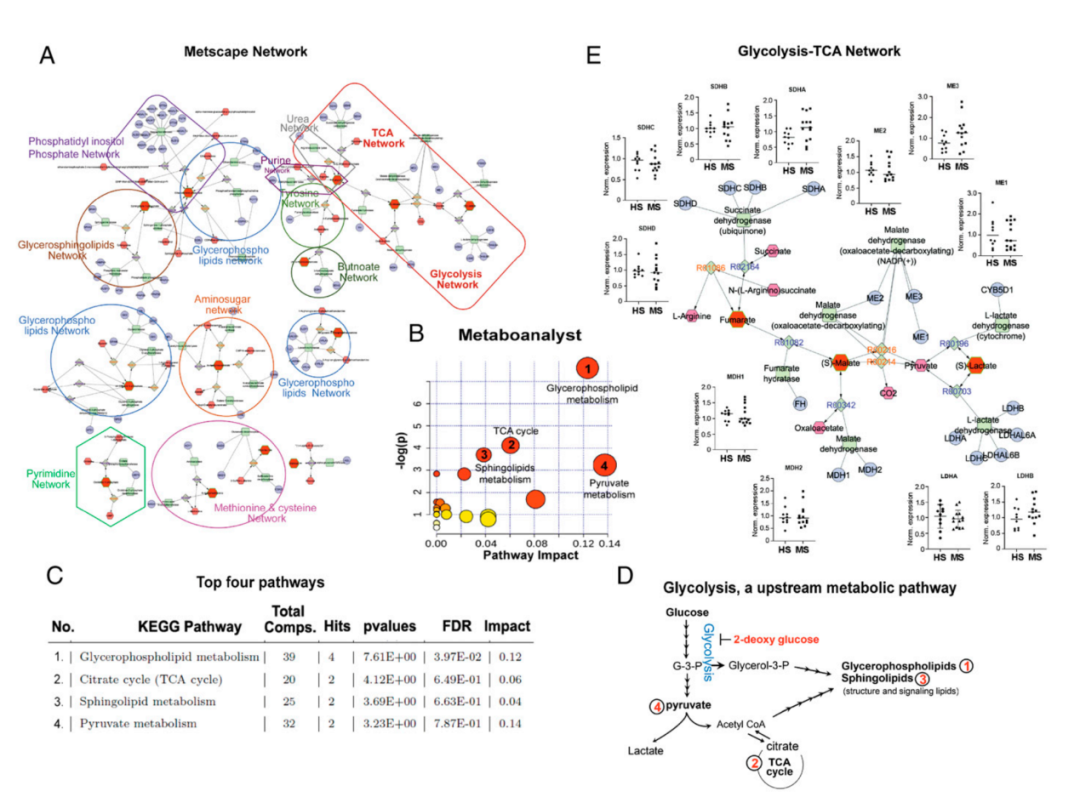
图2 | 生物信息学分析确定糖酵解是RRMS中改变的代谢途径的上游
根据上述分析作者发现糖酵解作为上游代谢途径与RRM存在关联性(图2),与HS相比,RRMS-PBMC的糖酵解活性显著增加(图3)。在EAE的临床前小鼠模型中也重复了这一观察结果,与对照组(CFA)相比,EAE组的PBMC表现出更高水平的糖酵解(图3)。这些发现明确表明,来自MS患者及其临床前小鼠的PBMC以更高的速率进行糖酵解。
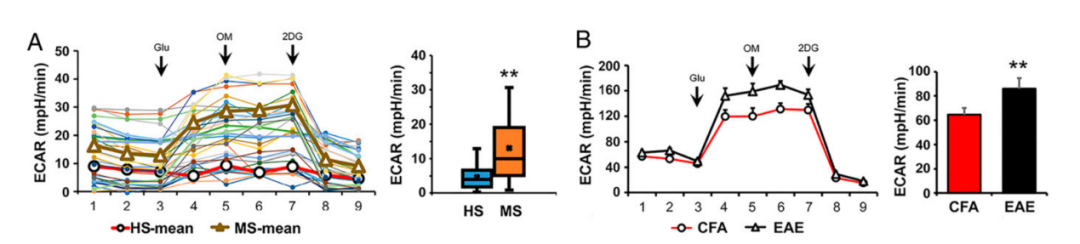
图3 | RRMS患者外周血单个核细胞和临床前小鼠模型(EAE)中观察到较高的糖酵解活性
2.与HS相比,RRMS患者外周血单个核细胞的糖酵解增加
作者对HS和RRMS患者衍生的PBMCs进行了糖酵解反应分析,以细胞外酸化率(ECAR)来衡量。HS和RRMS的PBMCs都对各种应激源做出了反应,并给出了典型的糖酵解曲线(图3 A)。然而,与HS相比,RRMS的PBMCs基础糖酵解明显较高(P<0.05),表明RRMS的PBMCs的糖酵解活性有内在的增加(图3 A)。这一观察结果也在EAE的临床前小鼠模型中得到了复制,EAE组的PBMC与CFA组相比,表现出更高的糖酵解水平(图3 B)。这些发现明确显示,多发性硬化症患者和其临床前小鼠的PBMCs进行糖酵解的速度增加。
3.使用 2-脱氧葡萄糖治疗靶向糖酵解改善了临床前 EAE 小鼠模型中的疾病进展
由于糖酵解在PBMCs中上调,并成为调节、连接、传输RRMS患者的四条改变的代谢途径的上游代谢途径,但是抑制糖酵解是否会影响MS疾病的进展尚不明确。于是作者采用2-脱氧葡萄糖(2DG),一种非代谢性的葡萄糖类似物和竞争性的己糖激酶抑制剂,用SJL小鼠在复发缓解的MS临床前模型来研究糖酵解抑制的效果。用蛋白脂蛋白(PLP)免疫EAE的小鼠,从免疫后第6天开始每天用2DG治疗,而对照组则注射PBS。用2DG治疗可显著降低疾病的严重程度(P<0.01),但不影响疾病的发生(图4 A)。与PBS组相比,用2DG治疗也能消除治疗组的复发(P<0.001,图4 A)。
在另外两种EAE小鼠模型中也观察到类似的疗效,2DG不仅能有效地延缓疾病的发生,而且还能降低疾病的严重程度((P<0.001),图4 B、C)。作者还研究了EAE模型中通过饮水口服2DG时的效果,与未治疗组相比,用2DG治疗的组别显示出疾病发生的延迟和疾病严重程度的降低(图4 D),表明2DG对减少EAE小鼠模型的疾病进展有积极影响。脊髓切片染色显示,浸润的单核细胞(MN)数量减少,髓鞘再生,这反映了治疗后EAE临床评分的下降(图4 E、F)。
此外,与PBS治疗的EAE小鼠相比,2DG治疗组的脱髓鞘现象也得到了明显缓解。因此作者认为在MS疾病的临床前模型中,2DG治疗可以减少免疫细胞的浸润,防止病变的发展,并促进髓鞘再生。
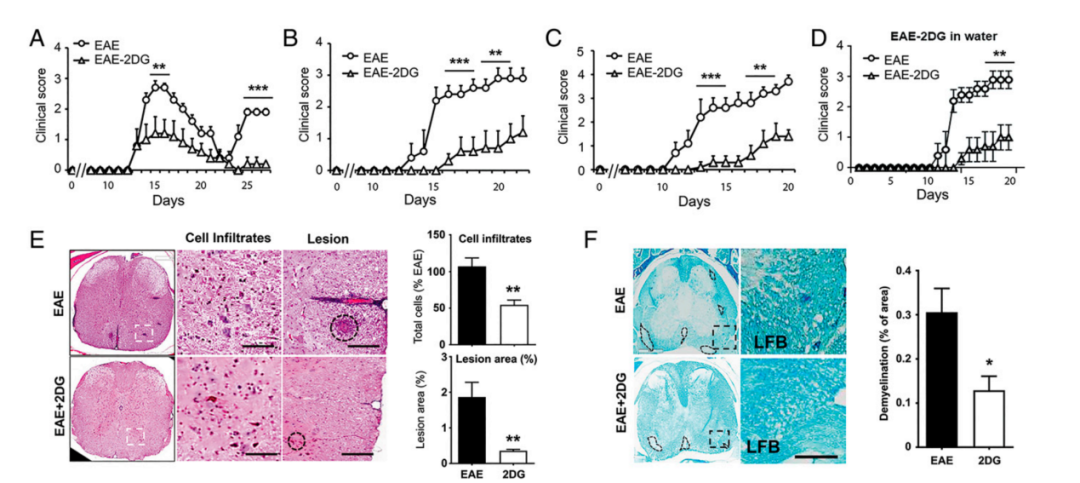
图4 | 靶向能量途径改善EAE小鼠模型的疾病进展
此外,为了研究2DG对髓鞘特异性免疫反应的影响,作者在免疫后第20天从2DG处理组和载体EAE组分离出脾脏细胞,用髓鞘少突胶质细胞糖蛋白(MOG)刺激它们72小时。96小时后用细胞增殖试验(Promega)检查细胞增殖情况,并将细胞上清液用于酶联免疫吸附试验,查看两组的炎症细胞因子状况。与未经处理的EAE组相比,2DG处理明显减少了抗原特异性细胞增殖,降低了IFN-γ、白细胞介素(IL)17和粒细胞-巨噬细胞集落刺激因子(GM-CSF)的水平,并诱导了IL-10的产生(图5 A)。与蛋白水平相一致,qPCR数据显示,所有细胞因子的信使RNA表达都因2DG处理而减少(图5 B)。
为了研究2DG介导的EAE保护的潜在机制,作者量化了中枢神经系统中浸润的MN细胞的绝对数量和它们产生促炎症细胞因子的能力。观察到,2DG治疗明显减少了浸润的MN细胞(CD45+)和CD4 T细胞(CD45+CD3+CD4+)的总数(图5 C),这是通过流式细胞仪和CD4的免疫组化染色所得出的结果(图5 D)。随着浸润的减少,CD4 T细胞也显示出细胞内促炎症细胞因子的减少,包括IFN-γ,IL-17,和GM-CSF(图5 E、F)。因此,在各种临床前模型中,2DG对糖酵解的抑制可以改善EAE的疾病进展,并且能够减少浸润性免疫细胞的数量和能力。
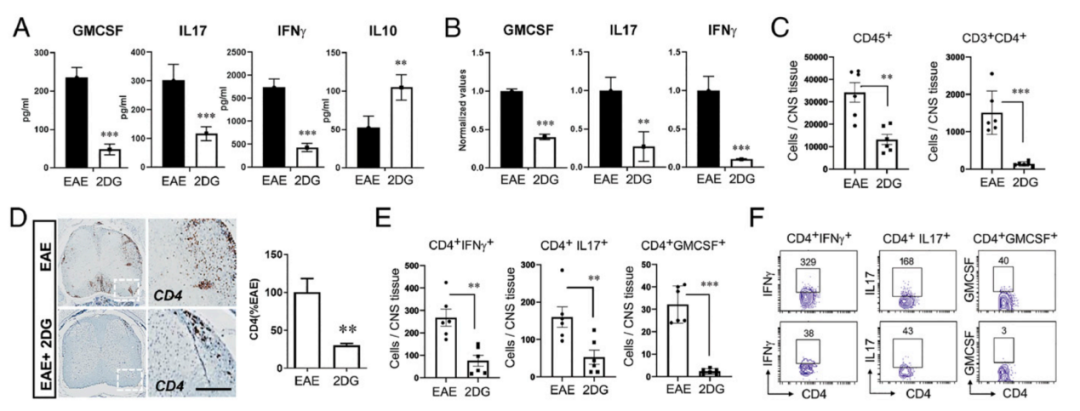
图5 | 靶向能量通路调节EAE小鼠CD4细胞浸润和应答
4.2DG对糖酵解的抑制恢复了EAE中单核细胞/巨噬细胞的代谢程序
单核细胞/巨噬细胞是多发性硬化症和EAE中脱髓鞘的主要影响因素,具有高度可塑性。一旦单核细胞在疾病期间渗入中枢神经系统,单核细胞则会分化为促炎症或抗炎症型巨噬细胞,它们的比例决定了EAE疾病的结果。作者研究了2DG对免疫后第20天单核细胞/巨噬细胞在中枢神经系统的浸润和表型的影响。与未治疗的EAE组相比,2DG治疗组的巨噬细胞的数量明显减少(图6 A)。这一观察也得到了脊髓腰部区域F4/80的免疫组化染色的支持(图6 B)。2DG融入细胞并被己糖激酶磷酸化,导致产生非代谢性的2-脱氧葡萄糖-6-磷酸(2DG6P),从而抑制糖酵解。
为了测试激活的单核细胞是否在疾病期间吸收2DG,作者在免疫后第20天用单核细胞分离试剂盒从2DG治疗和未治疗的EAE组的脾脏中分离出单核细胞,并估计2DG6P的含量。2DG治疗组的单核细胞的2DG6P水平明显较高(图6 C),表明在治疗的动物中2DG被单核细胞吸收。从2DG处理的EAE小鼠中分离出的单核细胞表现出葡萄糖摄取减少(图6 D),在培养基中乳酸分泌减少(图6 E),表明2DG处理抑制糖酵解。
为了进一步确定2DG对体内巨噬细胞代谢的影响,在免疫后第20天分离出脾脏巨噬细胞并进行糖酵解测量。结果发现,两组巨噬细胞中的糖酵解增强并没有促进能量的产生(图6 G)。经处理的小鼠的巨噬细胞显示出较高的代谢表型,而经2DG处理的巨噬细胞显示出较低的代谢状态,与健康对照组的巨噬细胞相似。与未治疗组相比,从2DG治疗的EAE中分离出的单核细胞/巨噬细胞的糖酵解减少与关键糖酵解酶的表达有关(图6 H)。
从用2DG处理的EAE小鼠中分离出的脾脏巨噬细胞显示出M2表型,促炎症表型减少,导致抗炎性/促炎性单核细胞/巨噬细胞表型的比例提高(图6 I)。流式细胞仪进一步证实了这一观察。随后在免疫后第6天将分离自2DG治疗或未经治疗的EAE组的单核细胞转移到有活动性EAE的受体B 6小鼠体内。与采用未经处理的EAE单核细胞组相比,采用转移的2DG处理过的单核细胞明显改善了EAE的严重程度,并将其转移到接受MOG免疫的B6小鼠体内(图6 K)。这些数据表明,2DG对糖酵解的抑制使单核细胞/巨噬细胞向抗炎表型分化,从而有能力抑制EAE的病程。
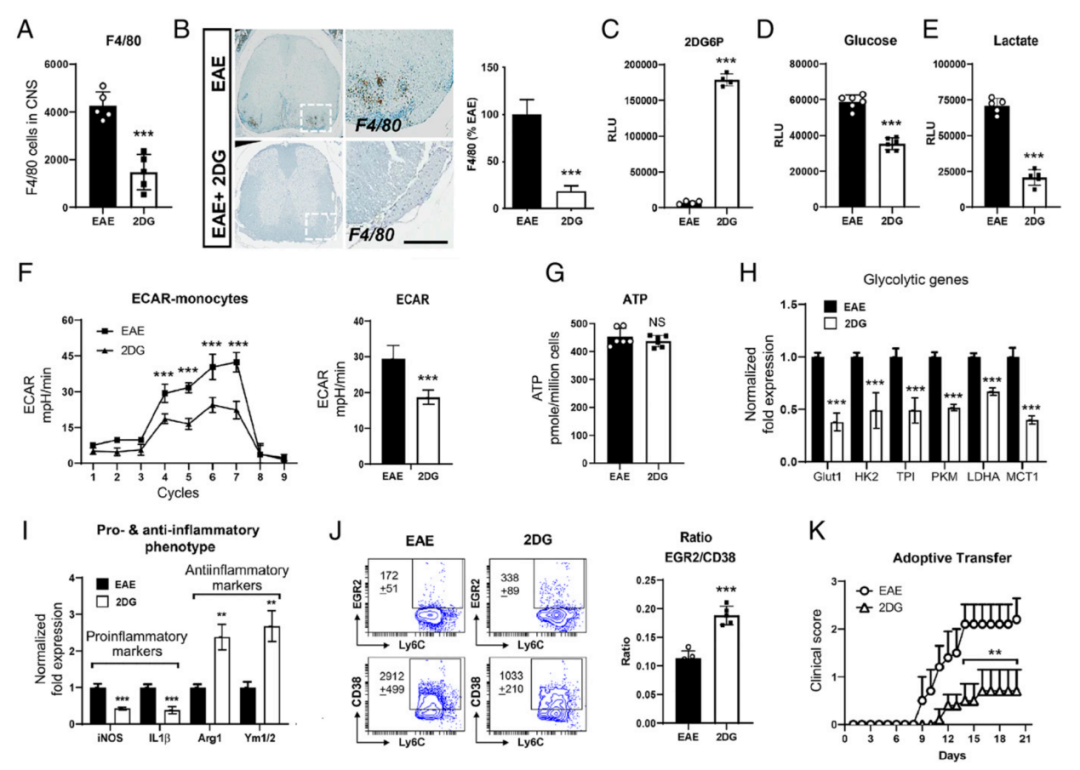
图6 | 2-脱氧葡萄糖通过破坏糖酵解代谢途径诱导单核细胞抗炎表型
5.2DG对糖酵解的抑制限制了神经炎症的发展
为了进一步检查2DG是否在中枢神经系统组织中积累,作者用LC-MS/MS检测了EAE组和2DG处理组的脊髓中2DG6P的水平。结果发现,与EAE组相比,2DG处理的EAE动物脊髓中的2DG6P水平明显较高(图7 A),这表明2DG能够进入中枢神经系统内部,并可能在调节免疫细胞的同时直接抑制神经炎症。为了确定2DG介导的保护机制,测试了2DG处理是否影响MOG刺激的MN细胞在中枢神经系统中诱发炎症的能力。
作者使用体外共培养模型,在有或没有2DG的情况下,用MOG35-55体外处理脾/淋巴结单悬液细胞。72小时后,来自两个处理组(MOG-CM和MOG-2DG-CM)的条件培养基和分离的MN细胞被用于进一步研究(图7 B)。与MOG-MNs共培养的混合胶质细胞显示炎症介质(iNOS)的表达和一氧化氮的产生增加,而2DG处理的MOG刺激的MNs细胞不能诱导混合胶质细胞的iNOS表达(图7 B、C)。同样,MOG刺激的MNs细胞诱导混合胶质细胞中促炎症细胞因子的表达;然而,2DG处理的MOG刺激的MNs与混合胶质细胞共培养时不能诱导细胞因子的产生(图7 D)。与MOG刺激的MNs混合胶质细胞共培养系统类似,MOG-CM也能诱导混合脑胶质细胞中炎症介质(iNOS)和细胞因子的表达,而与MOG-CM相比,2DG-CM加入混合胶质细胞的培养基中(1:1比例),能抑制iNOS表达和细胞因子产生(图7 E)总的来说,2DG对糖酵解的抑制改变了MN的功能和表型,导致对炎症和脱髓鞘的保护。
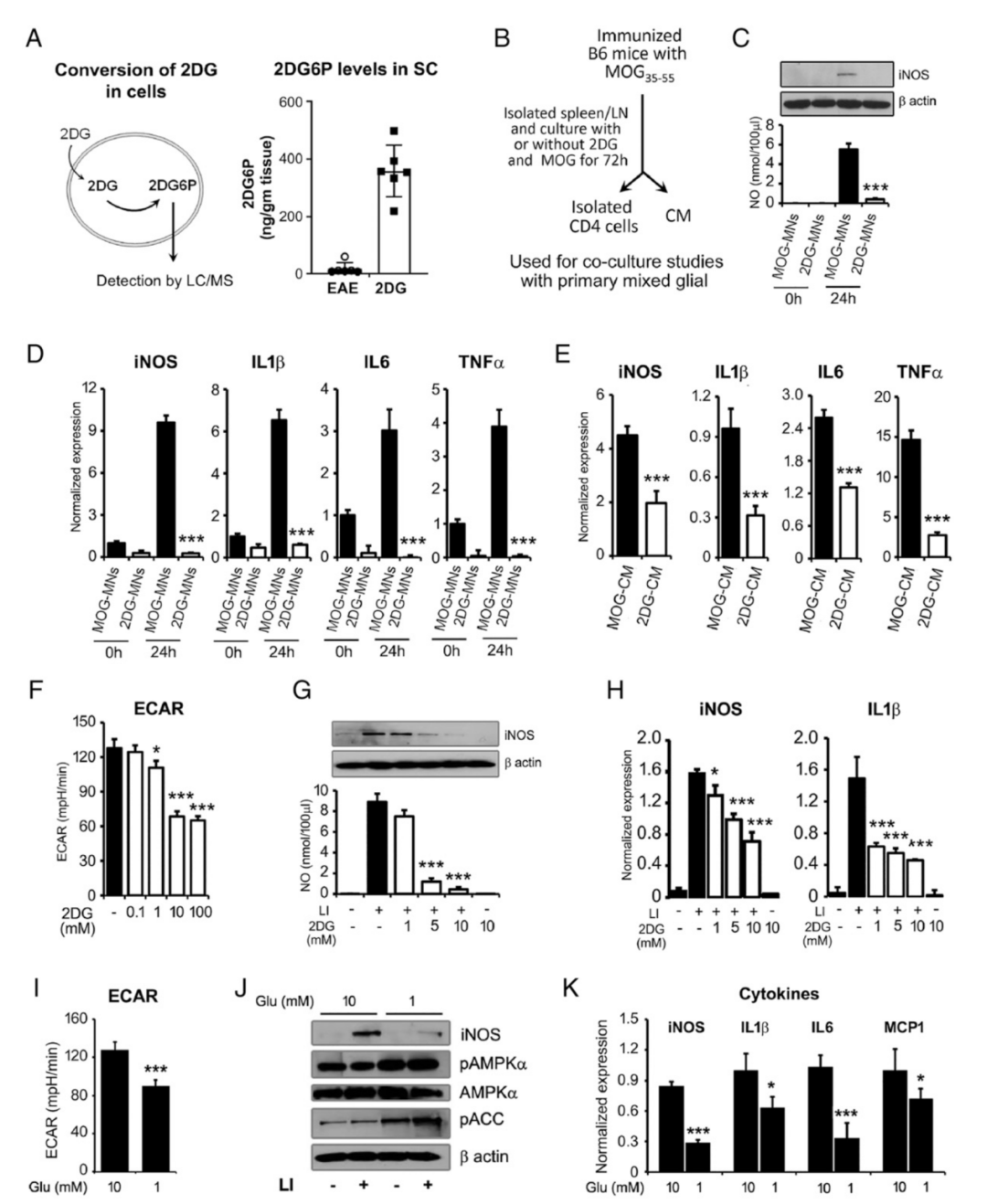
图7 | 糖酵解的减少抑制了脑胶质细胞的激活
相关讨论
作者通过代谢组学确定了正常和复发缓解受试者之间明显的代谢物分离,并确定了四条重要的途径,糖酵解是这些途径的中心连接点,这些途径因患者的疾病而受到影响。一方面,MS患者生物流体中观察到的代谢物特征可用于未来的生物标记物开发。另一方面,生物信息学揭示了一种常见的上游可测试代谢途径,即糖酵解,作者证明可以使用糖酵解抑制剂在MS小鼠模型中成功靶向。2DG介导的糖酵解抑制有力地表明了该策略对EAE疾病进展的有益作用。此外,对改变途径的深入研究可以深入了解该疾病的免疫病理机制。随后,作者的研究提供了额外的证据,通过观察患者免疫细胞中的改变的代谢型,支持MS和其他自身免疫疾病中存在代谢重编程,其定义为更高的糖酵解,这意味着有可能选择性地针对糖酵解途径进行未来的治疗干预。
小鹿推荐
本研究通过非靶代谢组学,确定了RRMS患者的甘油磷脂、柠檬酸盐循环、鞘磷脂和丙酮酸盐代谢这四条代谢途径发生显著改变,糖酵解作为这些途径的中心连接点与疾病显著相关,为RRMS治疗提供新的参考。

(扫码咨询鹿明生物工程师)
猜你还想看
1、水果特刊 | 看蛋白组学、代谢组学如何助力草莓、甜瓜、桃子、榴莲、荔枝发刊
2、Nature子刊 | 多组学联合分析鼠李糖乳杆菌与白色念珠菌之间的代谢争夺战
3、项目文章 | LC-MS、GC-MS非靶向代谢组学联合DIA蛋白质组学探究甲状腺毒症小鼠的衰老机制
4、项目文章| 蛋白质组学和代谢组学联合分析为早花百子莲胚性能力的获得提供见解
END
叮当|撰文
小久|排版
欢迎转发到朋友圈
本文系鹿明生物原创
转载请注明本文转自鹿明生物

我知道你在看哟


点击“阅读原文”了解更多
-
微信文章
-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章